摘要:A 解析:向试管中加入固体时.先把试管横放.防止打碎试管底部.
网址:http://m.1010jiajiao.com/timu3_id_14274[举报]
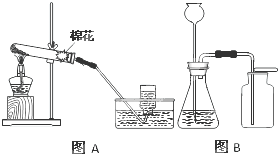 实验室常里用于制取氧气的方法有:a、加热氯酸钾晶体和二氧化锰粉末;
实验室常里用于制取氧气的方法有:a、加热氯酸钾晶体和二氧化锰粉末;b、加热高锰酸钾固体;c、用二氧化锰粉末作催化剂使过氧化氢(H2O2)溶液分解产生水和氧气.实验室制取氧气常用装置如下列图A、图B所示.请回答有关问题:
(1)请仔细分析图A的特点,推测所用制取氧气的方法是
b
b
(填“a”、“b”、“c”),写出该方法制取氧气的文字表达式
高锰酸钾
锰酸钾+二氧化锰+氧气
| 加热 |
高锰酸钾
锰酸钾+二氧化锰+氧气
该反应属于| 加热 |
分解
分解
反应.A中的试管口应略向下倾斜原因是防止冷凝水倒流引起试管炸裂
防止冷凝水倒流引起试管炸裂
.(2)采用c方法制氧气,应选用装置
B
B
(填“图A”、“图B”).为检验装置B中氧气是否收集满,可用带火星的木条放在集气瓶口,这是利用了氧气支持燃烧
支持燃烧
的性质.利用图A装置制氧气,在结束实验时要先撤离导管出水面,再熄灭酒精灯,其目的是防止水倒流引起试管炸裂
防止水倒流引起试管炸裂
;利用图B装置制氧气时,长颈漏斗的下端要插入液面以下,其目的是防止装置漏气(或防止气体从长颈漏斗逸出)
防止装置漏气(或防止气体从长颈漏斗逸出)
.(3)实验室里,常用氯化铵晶体跟氢氧化钙粉末混合加热制取氨气.它是一种无色的,有刺激性气味的,密度比空气小,而溶于水且能跟水反应生成氨水的气体,制取氨气过程中还有氯化钙和水生成.实验室制取氨气可选用的发生装置为
A
A
(填“A”或“B”),其理由是反应物为固体,需要加热
反应物为固体,需要加热
;收集氨气可用向下排空气
向下排空气
法,理由是氨气的密度比空气小、溶于水
氨气的密度比空气小、溶于水
.某校兴趣小组进行了“二氧化碳制备及其性质探究”的实验.试根据以下实验事实填空或简答.
(1)甲同学向分别盛有白色碳酸钠粉末、石灰石颗粒的两支试管内加入适量稀盐酸,仔细观察、思考并记录如下:
①盛白色粉末的试管内迅速冒出白色泡沫,片刻后形成平静的无色溶液.
②固体颗粒表面持续产生较多气泡,固体颗粒渐渐变小.
③反应过程中,用手握住盛白色粉末的试管底部,感觉微热.
④反应过程中,用手握住盛固体颗粒的试管底部,无明显发热感.
⑤碳酸钠与盐酸反应,能迅速产生CO2,难以控制.
⑥石灰石与盐酸反应,能持续、稳定地产生CO2,便于控制.
你认为甲同学的上述记录中,属于描述现象的是
(2)乙同学取两支小试管,分别倒入约3mL 蒸馏水,然后向其中一支试管内的蒸馏水中通入一会儿CO2,再分别向两支试管内各滴入相同滴数的紫色石蕊试液,观察两支试管内溶液颜色的变化.
你认为乙同学在观察溶液颜色变化过程中,还需要的操作是
(3)如图A~F是实验室制备某些常见气体的装置示意图.

(1)实验室制备CO2的文字表达式为:
可用的发生装置有:
(2)装置E或F相对于装置C在操作方面的优势为:
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
查看习题详情和答案>>
(1)甲同学向分别盛有白色碳酸钠粉末、石灰石颗粒的两支试管内加入适量稀盐酸,仔细观察、思考并记录如下:
①盛白色粉末的试管内迅速冒出白色泡沫,片刻后形成平静的无色溶液.
②固体颗粒表面持续产生较多气泡,固体颗粒渐渐变小.
③反应过程中,用手握住盛白色粉末的试管底部,感觉微热.
④反应过程中,用手握住盛固体颗粒的试管底部,无明显发热感.
⑤碳酸钠与盐酸反应,能迅速产生CO2,难以控制.
⑥石灰石与盐酸反应,能持续、稳定地产生CO2,便于控制.
你认为甲同学的上述记录中,属于描述现象的是
1234
1234
,属于实验结论的是56
56
(填序号).(2)乙同学取两支小试管,分别倒入约3mL 蒸馏水,然后向其中一支试管内的蒸馏水中通入一会儿CO2,再分别向两支试管内各滴入相同滴数的紫色石蕊试液,观察两支试管内溶液颜色的变化.
你认为乙同学在观察溶液颜色变化过程中,还需要的操作是
振荡
振荡
;其中另一支试管内不通入二氧化碳的目的是对比作用
对比作用
(3)如图A~F是实验室制备某些常见气体的装置示意图.

(1)实验室制备CO2的文字表达式为:
石灰石+稀盐酸→氯化钙+水+二氧化碳
石灰石+稀盐酸→氯化钙+水+二氧化碳
可用的发生装置有:
BCDEF
BCDEF
(选填上图字母序号).(2)装置E或F相对于装置C在操作方面的优势为:
能随时控制反应的发生和停止
能随时控制反应的发生和停止
.(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 不与空气反应 不与空气反应 |
| 收集过程分析 | 集满现象: 集气瓶内液面下降至瓶口,且气泡从瓶内向外冒出 集气瓶内液面下降至瓶口,且气泡从瓶内向外冒出 |
“验满”分析:因气体无色,故集满与否较难确定.即使用燃着木条移近容器口火焰熄灭,也难以证明空气完全排近 |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由上述实验可得结论 | (1) 排水法收集二氧化碳比排空气法更纯 排水法收集二氧化碳比排空气法更纯 (2)排水法集满现象明显好操作 排水法集满现象明显好操作 | |
某校兴趣小组进行了“二氧化碳制备及其性质探究”的实验.试根据以下实验事实填空或简答.
(1)甲同学向分别盛有白色碳酸钠粉末、石灰石颗粒的两支试管内加入适量稀盐酸,仔细观察、思考并记录如下:
①盛白色粉末的试管内迅速冒出白色泡沫,片刻后形成平静的无色溶液.
②固体颗粒表面持续产生较多气泡,固体颗粒渐渐变小.
③反应过程中,用手握住盛白色粉末的试管底部,感觉微热.
④反应过程中,用手握住盛固体颗粒的试管底部,无明显发热感.
⑤碳酸钠与盐酸反应,能迅速产生CO2,难以控制.
⑥石灰石与盐酸反应,能持续、稳定地产生CO2,便于控制.
你认为甲同学的上述记录中,属于描述现象的是______,属于实验结论的是______(填序号).
(2)乙同学取两支小试管,分别倒入约3mL 蒸馏水,然后向其中一支试管内的蒸馏水中通入一会儿CO2,再分别向两支试管内各滴入相同滴数的紫色石蕊试液,观察两支试管内溶液颜色的变化.
你认为乙同学在观察溶液颜色变化过程中,还需要的操作是______;其中另一支试管内不通入二氧化碳的目的是______
(3)如图A~F是实验室制备某些常见气体的装置示意图.
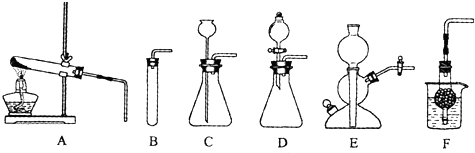
(1)实验室制备CO2的文字表达式为:______
可用的发生装置有:______(选填上图字母序号).
(2)装置E或F相对于装置C在操作方面的优势为:______.
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且______ |
| 收集过程分析 | 集满现象:______ | “验满”分析:因气体无色,故集满与否较难确定.即使用燃着木条移近容器口火焰熄灭,也难以证明空气完全排近 |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由上述实验可得结论 | (1)______(2)______ | |
某兴趣小组根据实验室提供的仪器和药品进行了气体的制备实验.
(1)甲同学选用如A图所示的装置制取氧气.
①写出仪器a的名称:________.
②甲同学应选取的试剂是________(填化学式)
③常温下,如在试管中分别加入下列物质,把带火星的木条伸入试管,不能使木条复燃的是________
A.5mL 5%的过氧化氢溶液
B.5mL 5%的过氧化氢溶液和少量二氧化锰
C.5mL 5%的过氧化氢溶液和氧化铁
D.5mL 5%的过氧化氢溶液和少量红砖粉末
B中MnO2固体在该反应中起________作用.
④实验前,甲同学先向仪器a中加入水,然后将导管放人水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现.该实验操作的目的是________.
检查B装置气密性,发现装置漏气,在图B中用箭头标出可能发生漏气的地方.
(2)乙同学称取一定质量KMnO4放在大试管中,如图B加热,将温度控制在250℃加热制取O2,该反应的化学方程式为________.
实验结束时,乙同学发现收集到的O2大于理论产量,针对这一现象,同学们进行了如下探究:
[提出猜想]
猜想l:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2.
请你补充猜想Ⅲ:________.
做出猜想l和Ⅱ的理由是________.
[实验验证]同学们分为两组,猜想l和Ⅱ来证明分别进行以下实验:
①第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变.则猜想________错误.
②第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.
该组同学选择的实验方法是________.
[拓展延伸]实验发现,K2MnO4受热只能部分分解,经分析可能是生成物K2O对其分解产生影响.请设计实验方案验证:________.
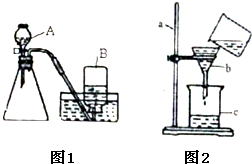
(3)丙同学设计了实验室制取CO2装置(如图1所示),
①装置中出现了一个错误,你的纠正方法是________;
②锥形瓶中发生反应的化学方程式为________;
③此装置的优点是________.
查看习题详情和答案>>
 某化学兴趣小组的同学对实验室制取氧气的实验展开了如下探究:
某化学兴趣小组的同学对实验室制取氧气的实验展开了如下探究:
(1)小明同学选用如图1所示的装置制取氧气.制取过程中所发生反应的化学反应方程式为:________.实验前小明同学先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现.该实验操作的目的是________.
(2)小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.
【提出问题】
氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】
小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | l | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
②若实验②比实验①的“待测数据”更________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率.
③将实验②反应后的固体经提纯分离仍得到0.5克黑色粉末,再将黑色粉末放入试管中,________(简述操作和现象),说明氧化铜还能作氯酸钾的催化剂.
【评价设计】你认为小雨设计实验③和实验②对比的目的是________.
(3)小林同学对“过氧化氢溶液的浓度对反应速度有何影响”展开如下探究:取不同浓度的过氧化氢溶液,在其他条件相同的情况下进行实验,记录数据如下:
| 实验 | 1 | 2 | 3 | 4 | 5 |
| 过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% |
| MnO2粉末用量/g | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 收集到500mL气体时所用时间/秒 | 560 | 186 | 103 | 35 | 12 |
②小芳同学验证实验后二氧化锰的质量是否仍为0.5g,她取反应后的溶液进行如下操作:________、洗涤、干燥、称量,她用如图2所示的装置进行实验,试指出图中的三处错误________;________;________. 查看习题详情和答案>>