摘要:高锰酸钾(KMnO4).氯酸钾(KClO3)中氧的质量分数分别为40.5%和39.2%.实验室里.将等质量的高锰酸钾与氯酸钾分别加热至完全反应.生成氧气的量较多的是 .从氯酸钾加热分解后的残留物中分离出不溶于水的二氧化锰.可采用的方法是 .
网址:http://m.1010jiajiao.com/timu3_id_13654[举报]
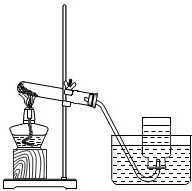 探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变.
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热.结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少.
实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克.
实验三、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生.根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;如何验证集气瓶中的气体为氧气
| ||
| △ |
用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气
用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气
.(2)通过上述三个实验能说明
二氧化锰在反应中起催化作用,加快了反应的速率,自身的质量和化学性质在化学反应前后没有发生变化
二氧化锰在反应中起催化作用,加快了反应的速率,自身的质量和化学性质在化学反应前后没有发生变化
.(3)某同学用KClO3和KMnO4的混合物加热,发现产生氧气的速度也很快,该同学就断定KMnO4在KClO3分解反应中也能起催化作用,你认为这同学的判断对吗?
不对
不对
;为什么?加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用
加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用
.(2013?株洲)某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验.
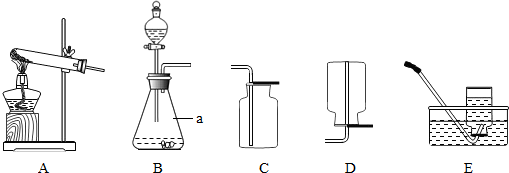
(1)写出仪器a的名称:
(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为:
(3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】
猜想Ⅰ:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解放出O2.
【实验验证】同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜测
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
【实验反思】通过以上实验探究,你对“实验制取氧气”还想探究的问题是
查看习题详情和答案>>

(1)写出仪器a的名称:
锥形瓶
锥形瓶
.(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.在用脚皮管连接装置B和E中的玻璃导管时,应先把玻璃管口
| ||
润湿
润湿
,然后稍稍用力把玻璃管插入胶皮管.收集气体前,应将集气瓶装满水
水
并盖上玻璃片
玻璃片
.收集氧气还可选用的装置是C
C
.(3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】
猜想Ⅰ:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解放出O2.
【实验验证】同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜测
Ⅰ
Ⅰ
错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是将带火星的木条放入试管内
将带火星的木条放入试管内
.【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用
高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用
.【实验反思】通过以上实验探究,你对“实验制取氧气”还想探究的问题是
氯酸钾分解的最佳温度是多少
氯酸钾分解的最佳温度是多少
.某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从图中选择装置进行了气体的制备实验.
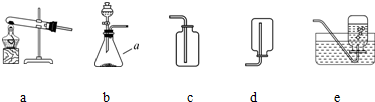
(1)写出仪器a的名称:
(2)甲同学从上图中选择B、E装置的组合制取氧气,其中分液漏斗的作用是
(3)乙同学选用装置
(4)丙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想 I:反应生成的MnO2分解放出O2;
猜想 II:反应生成的K2MnO4分解放出O2;
猜想 III:反应生成的K2MnO4和MnO2分解都放出O2.
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想
【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快.请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
查看习题详情和答案>>

(1)写出仪器a的名称:
锥形瓶
锥形瓶
.(2)甲同学从上图中选择B、E装置的组合制取氧气,其中分液漏斗的作用是
控制液体滴加的速度,从而控制反应速度
控制液体滴加的速度,从而控制反应速度
,收集氧气还可选用的装置是C
C
,反应的文字表达式为过氧化氢
水+氧气
| 二氧化锰 |
过氧化氢
水+氧气
.在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口| 二氧化锰 |
润湿
润湿
,然后稍稍用力把玻璃管插入胶皮管.收集气体前,应将集气瓶装满水
水
并盖上玻璃片
玻璃片
;当气泡均匀连续
气泡均匀连续
时,开始收集氧气;当瓶口有气泡冒出时
瓶口有气泡冒出时
时,表明该瓶内的氧气已满.(3)乙同学选用装置
B
B
和C
C
的组合制取二氧化碳,反应的文字表达式为碳酸钙+盐酸→氯化钙+二氧化碳+水
碳酸钙+盐酸→氯化钙+二氧化碳+水
.(4)丙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现用排水法收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想 I:反应生成的MnO2分解放出O2;
猜想 II:反应生成的K2MnO4分解放出O2;
猜想 III:反应生成的K2MnO4和MnO2分解都放出O2.
【实验验证】同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想
I
I
错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想 II正确的结论.该组同学选择的实验方法是将带火星的木条放入试管内
将带火星的木条放入试管内
.【拓展延伸】实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快.请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?
高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用.
高锰酸钾不是催化剂,加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用.
.