网址:http://m.1010jiajiao.com/timu3_id_1353395[举报]
写出下列反应过程的离子方程式:
①在NaOH和NaAlO2溶液中滴加盐酸至过量
、 、
②在NaOH和Na2CO3的混合溶液中滴加盐酸至过量
、 、
③在Ba(OH)2溶液中通入过量、、SO2____________、___________________________
④在NH4HCO3溶液中加入足量Ba(OH)2溶液_______、_______________
查看习题详情和答案>>下表是某食用碘盐包装袋上的部分说明:
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,
在一定条件下电解,反应的方程式为KI + 3H2O![]() KIO3 + 3H2↑。则阳极电极反应式为
KIO3 + 3H2↑。则阳极电极反应式为
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
查看习题详情和答案>>已知反应:(1)10IkPa时;2C(S)+O2( g)=2CO(g) △H=-221kJ/mol
(2)在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol下列结论正确的是 ( )
A.碳的燃烧热大于110.5kJ/mol
B.反应(1)的反应热为221 kJ/mol
C.稀硫酸和稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸和稀NaOH溶液反应生成1 mol水,放出57.3kJ热量
查看习题详情和答案>>下列有关实验的叙述中,正确的是 ( )
①用湿润的pH试纸测定溶液的pH
②不宜用瓷坩埚熔融氢氧化钠固体或碳酸钠固体
③可用加热法分离I2和NH4Cl的混合物
④可用稀硝酸洗涤“银镜反应”实验后附着在试管壁上的银
⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体
⑥实验室配制氯化亚铁溶液时,可先将氯化亚铁溶解在盐酸中,再加入蒸馏水稀释,最后加入少量铁粉
A.①②④ B.②③⑥ C.②④⑥ D.②③④⑤⑥
查看习题详情和答案>>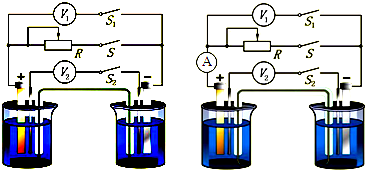
(1)当开关S、S2断开、S1闭合时,电压V1的读数
(2)闭合所有开关,并逐渐改变滑动变阻器阻值,观察电压表V1、V2示数的变化,得到如下所示的数据:
| 实验顺次 | 1 | 2 | 3 | 4 | 5 |
| 电压表(V1) | 1.10V | 1.07V | 1.05V | 1.03V | 1.00V |
| 电压表(V2) | 0.10V | 0.13V | 0.15V | 0.17V | 0.20V |
(3)若在电路中如图接入一电流表,将开关S、S2闭合,S1断开,此时电压表、电流表读数分别为0.13V、0.50A,由此可测得电源的内阻为