摘要:10.在一定温度下.将少量无水硫酸铜加入一定量饱和硫酸铜溶液中.保持温度不变.下列说法正确的是----------------------------------------------------------------------------- A.溶质质量不变 B. 溶剂质量不变 C.溶液浓度不变 D.析出的晶体质量与加入的无水硫酸铜质量不变
网址:http://m.1010jiajiao.com/timu3_id_13482[举报]
无水硫酸铜(CuSO4)是白色粉末,具有很强的吸水性.吸水后白色粉末转化为蓝色晶体-胆矾.
(1)露置在空气中的无水硫酸铜吸收水蒸汽得到胆矾,这一变化过程属于 变化(填“物理”或“化学”).
(2)通常状态下,某无色气体可能含有CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行,且只考虑初中阶段常见的反应):①通过赤热的炭层后,恢复到原状态,气体质量变大;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊.通过以上实验事实可以判定,原混合气体中一定有 .
(3)在一定温度下,向一定量的饱和硫酸铜溶液中加入少量无水硫酸铜,一段时间后,观察到白色粉末转变为蓝色晶体,溶液的质量将 (选填“增大”、“减小”或“不变”,下同),溶质质量分数将 .
(4)某课外研究小组通过下图所示两种不同的途径制取胆矾晶体.

途径1中铜发生反应的化学方程式为“Cu+2H2SO4(浓)?CuSO4+2H2O+SO2↑”;
途径2中铜发生反应的生成物是硫酸铜和水.
请写出途径2中发生反应的化学方程式: .
与途径1相比,排除安全因素,途径2主要具有两项优点:不污染大气和 . 查看习题详情和答案>>
(1)露置在空气中的无水硫酸铜吸收水蒸汽得到胆矾,这一变化过程属于 变化(填“物理”或“化学”).
(2)通常状态下,某无色气体可能含有CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行,且只考虑初中阶段常见的反应):①通过赤热的炭层后,恢复到原状态,气体质量变大;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊.通过以上实验事实可以判定,原混合气体中一定有 .
(3)在一定温度下,向一定量的饱和硫酸铜溶液中加入少量无水硫酸铜,一段时间后,观察到白色粉末转变为蓝色晶体,溶液的质量将 (选填“增大”、“减小”或“不变”,下同),溶质质量分数将 .
(4)某课外研究小组通过下图所示两种不同的途径制取胆矾晶体.

途径1中铜发生反应的化学方程式为“Cu+2H2SO4(浓)?CuSO4+2H2O+SO2↑”;
途径2中铜发生反应的生成物是硫酸铜和水.
请写出途径2中发生反应的化学方程式: .
与途径1相比,排除安全因素,途径2主要具有两项优点:不污染大气和 . 查看习题详情和答案>>
11、无水硫酸铜(CuSO4)是白色粉末,具有很强的吸水性.吸水后白色粉末转化为蓝色晶体-胆矾(CuSO4?5H2O).
(1)露置在空气中的无水硫酸铜吸收水蒸汽得到胆矾,这一变化过程属于
(2)通常状态下,某无色气体可能含有CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行,且只考虑初中阶段常见的反应):①通过赤热的炭层后,恢复到原状态,气体质量变大;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊.通过以上实验事实可以判定,原混合气体中一定有
(3)在一定温度下,向一定量的饱和硫酸铜溶液中加入少量无水硫酸铜,一段时间后,观察到白色粉末转变为蓝色晶体,溶液的质量将
(4)某课外研究小组通过下图所示两种不同的途径制取胆矾晶体.

途径1中铜发生反应的化学方程式为“Cu+2H2SO4(浓)?CuSO4+2H2O+SO2↑”;
途径2中铜发生反应的生成物是硫酸铜和水.
请写出途径2中发生反应的化学方程式:
与途径1相比,排除安全因素,途径2主要具有两项优点:不污染大气和
查看习题详情和答案>>
(1)露置在空气中的无水硫酸铜吸收水蒸汽得到胆矾,这一变化过程属于
化学
变化(填“物理”或“化学”).(2)通常状态下,某无色气体可能含有CO2、CO、H2中的一种或几种,依次进行以下实验(假设每步反应均完全进行,且只考虑初中阶段常见的反应):①通过赤热的炭层后,恢复到原状态,气体质量变大;②通过灼热的CuO时,固体变成红色;③通过白色CuSO4粉末时,粉末变成蓝色晶体;④通入澄清石灰水中,石灰水变浑浊.通过以上实验事实可以判定,原混合气体中一定有
CO2、H2
.(3)在一定温度下,向一定量的饱和硫酸铜溶液中加入少量无水硫酸铜,一段时间后,观察到白色粉末转变为蓝色晶体,溶液的质量将
减小
(选填“增大”、“减小”或“不变”,下同),溶质质量分数将不变
.(4)某课外研究小组通过下图所示两种不同的途径制取胆矾晶体.

途径1中铜发生反应的化学方程式为“Cu+2H2SO4(浓)?CuSO4+2H2O+SO2↑”;
途径2中铜发生反应的生成物是硫酸铜和水.
请写出途径2中发生反应的化学方程式:
2Cu+O2+2H2SO4?2CuSO4+2H2O
.与途径1相比,排除安全因素,途径2主要具有两项优点:不污染大气和
节约原料硫酸(或硫酸的消耗量相对较低)
. 溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据右图的溶解度曲线回答下列问题:
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利.请你根据右图的溶解度曲线回答下列问题:(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是
C>B>A
C>B>A
;(2)在t2℃时,A物质与B物质的溶解度都是
60
60
g.(3)当A中混有少量B时,可用
降温结晶或冷却热饱和溶液
降温结晶或冷却热饱和溶液
方法提纯A;(4)在t1℃时,将25g物质A加入到盛有50g水的烧杯中,充分搅拌,所得溶液中溶质的质量分数是
28.6%
28.6%
;(5)将 t1℃时A、B、C三种物质的饱和溶液升温至t2℃(溶剂不变),有晶体析出的是
C
C
.(6)请你各举一个实例,说明下列有关溶液的叙述是错误的:
溶液一定是无色的.实例:
硫酸铜
硫酸铜
溶液,不是无色的.溶液中的溶质一定是固体.实例:
酒精
酒精
可作溶质,但不是固体.(2012?润州区二模)在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4?XH2O).
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水.对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解.
(2)CuSO4?XH2O可溶于水,在加热时会生成CuSO4和H2O.
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程: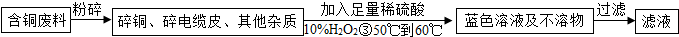
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是:
(2)从环保角度对两套方案的不同部分进行比较,你认为方案
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体.晶体采用酒精淋洗的优点是
II、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,
获得相关数据,并绘制成固体质量一温度的关系如图.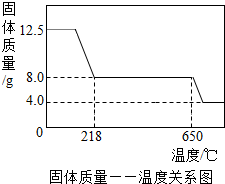
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
(3)根据图中数据,计算CuSO4?xH2O中x的值为
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式:
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
查看习题详情和答案>>
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水.对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解.
(2)CuSO4?XH2O可溶于水,在加热时会生成CuSO4和H2O.
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:

方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:
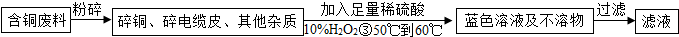
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是:
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
.(2)从环保角度对两套方案的不同部分进行比较,你认为方案
2
2
(填1或2)更合理.理由是:耗能少或无污染
耗能少或无污染
.(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为
防止H2O2受热分解
防止H2O2受热分解
.(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
将浓硫酸沿烧杯壁缓缓倒入水中
将浓硫酸沿烧杯壁缓缓倒入水中
并用玻璃棒不断搅拌
并用玻璃棒不断搅拌
.(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体.晶体采用酒精淋洗的优点是
减少硫酸铜晶体因溶于水而损失
减少硫酸铜晶体因溶于水而损失
.II、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,
获得相关数据,并绘制成固体质量一温度的关系如图.

(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为
白
白
色,最终变为黑色;(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
2CuSO4
2CuO+2SO2↑+O2↑;
| ||
2CuSO4
2CuO+2SO2↑+O2↑;
;
| ||
(3)根据图中数据,计算CuSO4?xH2O中x的值为
5
5
.(请写出计算过程)(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式:
Cu2O
Cu2O
.Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
+2
+2
.碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3?Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为CuSO4?3Cu(OH)2
CuSO4?3Cu(OH)2
,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是蛋白质
蛋白质
(填一种有机物名称).