网址:http://m.1010jiajiao.com/timu3_id_13244[举报]
(14分)某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
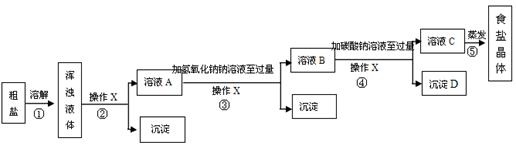
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(2)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(3)有同学认为原实验方案不完善,做出这种评价的依据是 。
二、用途之二:制备氯气。
工业上用电解饱和食盐水来制备氯气,可以得到多种化工产品,除氯气(Cl2)外,还生成密度最小的气体,向反应后的溶液中滴加无色酚酞试液,溶液变红,请写出发生反应的化学方程式 。
三、用途之三:工业制碱。
某厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
【相关资料】
⑴ NH4Cl△NH3↑+HCl↑
⑵已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【生产流程】如下
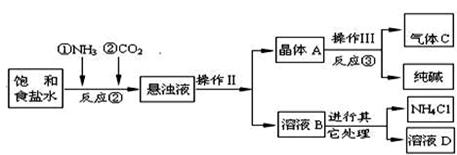
【问题讨论】:
(1)反应③中得到纯碱的化学方程式为: 。
(2)检验气体C的方法 。
(3)在反应②中,先通 气体,目的是 。
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算判断此纯碱样品的纯度为 。(保留一位小数)
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。 查看习题详情和答案>>
人类社会的发展离不开能源。当今社会,人类利用的能源主要来自化石燃料。(1)用来驱动汽车、飞机和轮船的燃料主要是从石油中根据不同沸点范围分馏出来的汽油、航空煤油、柴油等,石油分馏的过程属__________变化。化石燃料中主要含有碳、氢元素,完全燃烧的产物是_____________,还含有硫、氮等元素,燃烧时会转化为_________________。
(2)西气东输,将改变我市居民的气体燃料结构。下表是几种气体燃料的价格和热值:
|
燃烧物 |
煤气 |
液化石油气 |
天然气 |
|
价格 |
1.4元/千克 |
6.0元/千克 |
1.8元/千克 |
|
热值 |
1.56×104kJ/kg |
4.5×104kJ/kg |
3.9×104kJ/kg |
综合考虑,你将选用哪种燃料 理由是________________ 。
(3)化石燃料不仅是优质的能量资源,还是宝贵的化工资源。聚乙烯是一种最常用的塑料,它是以石油裂解气体乙烯(CH2=CH2)为原料,经许多乙烯分子打开双键(-CH2-CH2-)连在一起,聚合成大分子而形成的。下图是聚乙烯分子形成过程的示意图,卡通画中单个小人代表一个乙烯分子。聚乙烯其中的部分结构可表示为:… …。
(4)开发和利用清洁高效而又用之不竭的新能源,是21世纪人类面临的重要课题。①2006年1月起,我省苏北四市推广使用乙醇汽油。乙醇可利用农作物发酵制得,农作物在催化剂作用下转化为葡萄糖(C6H12O6),然后葡萄糖在酒化酶的作用下转化为乙醇和二氧化碳,写出葡萄糖转化为乙醇的化学方程式 _________ 。
②氢气是一种未来理想的能源。现通过生物法制得的氢气中混有CO2、O2和水蒸气等(氢气的体积分数通常为60℅~90℅),为了得到纯净的氢气,将混合气体依次通过NaOH溶液、灼热的Cu丝和干燥装置。该除杂方案是否正确? ,理由是
。
【解析】(1)没有新物质生成的变化属于物理变化,含有碳、氢元素的物质完全燃烧能生成水和二氧化碳,含有的硫、氮等元素,燃烧时会转化为二氧化硫和氮的氧化物;
(2)可以通过计算单位价格购买的热量来选择燃料.
(3)本题是一信息给予题,通过题中信息进行分析解答.
(4)①书写化学方程式时首先要正确写出反应物和生成物的化学式,然后配平,再注明反应条件.
②除去一种气体中的其他杂质时,要选择适当的物质并注意除杂的顺序,还有除杂过程中可能发生的反应等.当氢气和氧气混合遇到高温或明火时有可能发生爆炸.
查看习题详情和答案>>
(1)该溶液可以与空气中的
方法一:取样,用pH试纸测溶液酸碱度,若pH<7,则说明该溶液没有变质.
方法二:取样加入硫酸铜溶液,若有蓝色沉淀产生,则说明溶液已变质.
方法三:取样,加入氯化钡溶液,若有白色沉淀生成,则说明溶液已变质.
艺博同学提出了更为简单的方法,他进行了取样并加入稀盐酸,观察到样品中
(2)在上述实验中是否发生了化学反应呢,如何来证明?聪明的艺博认为只要借助酚酞试液就可以判断,其理由是
(3)谢笛同学提出利用已学的化学知识粗略计算样品中NaOH溶液的溶质质量分数,重新书写标签.艺博同学依据中和反应的原理,设计了如下实验方案,并进行了其操作.
第一步:向锥形瓶中加入15mL的该NaOH溶液样品;
第二步:向上述烧杯中滴2滴酚酞试液,充分振荡;
第三步:向20mL的量筒里注入20mL溶质质量分数为5%的盐酸;
第四步:用胶头滴管吸取少许量筒中的盐酸,逐滴滴入上述烧杯中,一直滴到烧杯中溶液由红色刚刚变成无色为止.停止滴入盐酸后,胶头滴管中残留的盐酸应
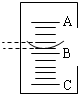
第五步:记录实验数据,其在量筒中的液面如图所示,已知A与B、B与C刻度均相差1mL,如果A刻度为7,量筒中盐酸的体积是
第六步:计算,确定该氢氧化钠溶液中NaOH的溶质质量分数.(请写出具体的计算过程,氢氧化钠溶液和盐酸密度均以1.0g/mL计,结果保留一位小数)
 查看习题详情和答案>>
查看习题详情和答案>>
保持实验室干净整洁、实验用品的整齐有序会给做实验带来许多便利.为此,某实验小组做完实验后主动提出留下帮助实验员整理仪器.整理过程中,艺博和谢笛两名同学发现实验用品橱的一角放着一瓶标签已破损氢氧化钠溶液,决定对其进行探究.
(1)该溶液可以与空气中的______反应而发生变质,其是否变质呢?旁边的谢笛同学提出如下三种方法来检验,你认为合理的是______.(填“方法一”或“方法二”或“方法三”)
方法一:取样,用pH试纸测溶液酸碱度,若pH<7,则说明该溶液没有变质.
方法二:取样加入硫酸铜溶液,若有蓝色沉淀产生,则说明溶液已变质.
方法三:取样,加入氯化钡溶液,若有白色沉淀生成,则说明溶液已变质.
艺博同学提出了更为简单的方法,他进行了取样并加入稀盐酸,观察到样品中______(填实验现象),由此得出结论,该瓶试剂未变质.在此过程中涉及的反应化学方程式为______.
(2)在上述实验中是否发生了化学反应呢,如何来证明?聪明的艺博认为只要借助酚酞试液就可以判断,其理由是______.
(3)谢笛同学提出利用已学的化学知识粗略计算样品中NaOH溶液的溶质质量分数,重新书写标签.艺博同学依据中和反应的原理,设计了如下实验方案,并进行了其操作.
第一步:向锥形瓶中加入15mL的该NaOH溶液样品;
第二步:向上述烧杯中滴2滴酚酞试液,充分振荡;
第三步:向20mL的量筒里注入20mL溶质质量分数为5%的盐酸;
第四步:用胶头滴管吸取少许量筒中的盐酸,逐滴滴入上述烧杯中,一直滴到烧杯中溶液由红色刚刚变成无色为止.停止滴入盐酸后,胶头滴管中残留的盐酸应______(填操作过程).
第五步:记录实验数据,其在量筒中的液面如图所示,已知A与B、B与C刻度均相差1mL,如果A刻度为7,量筒中盐酸的体积是______ mL.
第六步:计算,确定该氢氧化钠溶液中NaOH的溶质质量分数.(请写出具体的计算过程,氢氧化钠溶液和盐酸密度均以1.0g/mL计,结果保留一位小数)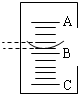
查看习题详情和答案>>
(1)该溶液可以与空气中的______反应而发生变质,其是否变质呢?旁边的谢笛同学提出如下三种方法来检验,你认为合理的是______.(填“方法一”或“方法二”或“方法三”)
方法一:取样,用pH试纸测溶液酸碱度,若pH<7,则说明该溶液没有变质.
方法二:取样加入硫酸铜溶液,若有蓝色沉淀产生,则说明溶液已变质.
方法三:取样,加入氯化钡溶液,若有白色沉淀生成,则说明溶液已变质.
艺博同学提出了更为简单的方法,他进行了取样并加入稀盐酸,观察到样品中______(填实验现象),由此得出结论,该瓶试剂未变质.在此过程中涉及的反应化学方程式为______.
(2)在上述实验中是否发生了化学反应呢,如何来证明?聪明的艺博认为只要借助酚酞试液就可以判断,其理由是______.
(3)谢笛同学提出利用已学的化学知识粗略计算样品中NaOH溶液的溶质质量分数,重新书写标签.艺博同学依据中和反应的原理,设计了如下实验方案,并进行了其操作.
第一步:向锥形瓶中加入15mL的该NaOH溶液样品;
第二步:向上述烧杯中滴2滴酚酞试液,充分振荡;
第三步:向20mL的量筒里注入20mL溶质质量分数为5%的盐酸;
第四步:用胶头滴管吸取少许量筒中的盐酸,逐滴滴入上述烧杯中,一直滴到烧杯中溶液由红色刚刚变成无色为止.停止滴入盐酸后,胶头滴管中残留的盐酸应______(填操作过程).
第五步:记录实验数据,其在量筒中的液面如图所示,已知A与B、B与C刻度均相差1mL,如果A刻度为7,量筒中盐酸的体积是______ mL.
第六步:计算,确定该氢氧化钠溶液中NaOH的溶质质量分数.(请写出具体的计算过程,氢氧化钠溶液和盐酸密度均以1.0g/mL计,结果保留一位小数)
 查看习题详情和答案>>
查看习题详情和答案>>