网址:http://m.1010jiajiao.com/timu3_id_1246937[举报]
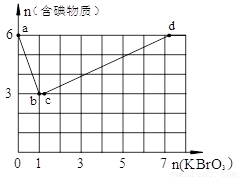
(14分)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示。请回答下列问题:
(1)b点时,KI反应完全,则氧化产物与还原产物的物 质的量之比为____,电子转移数目为 。
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应的离子方程式 。
(3)已知在c→d段发生下列反应:= mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为 g。
(4)含a mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为____。整个过程中转移的电子数目为____。
查看习题详情和答案>>
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- +Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为 。
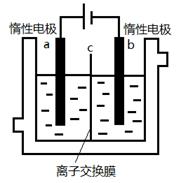
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 ;阴极观察到的现象是 ;
查看习题详情和答案>>
(14分)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示。请回答下列问题:
(1)b点时,KI反应完全,则氧化产物与还原产物的物 质的量之比为____,电子转移数目为 。
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应的离子方程式 。
(3)已知在c→d段发生下列反应: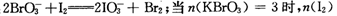 = mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为 g。
= mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为 g。
(4)含a mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为____。整个过程中转移的电子数目为____。
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知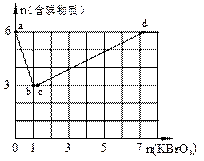
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 ;阴极观察到的现象是 ;