摘要: 如图为原电池装置示意图: (1)若A为Zn.B为石墨棒.电解质溶液为稀硫酸.则A电极名称为 .写出正极的电极反应式 . (2)若A为铜片.B为铁片.电解质为CuCl2溶液.则作铜片为极.写出电极反应式:正极 .负极 . (3)若A.B均为铂片.电解质为KOH溶液.分别从A.B两极通入H2和O2.该电池即为燃料电池.通入氧气的一极为该电池的 极.该电池的总反应为: .
网址:http://m.1010jiajiao.com/timu3_id_1244235[举报]
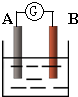 如图为原电池装置示意图:
如图为原电池装置示意图:(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为
负极
负极
,写出正极的电极反应式2H++2e-=H2↑
2H++2e-=H2↑
.(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为
正
正
极(填正或负),写出电极反应式:正极2Fe3++2e-=2Fe2+
2Fe3++2e-=2Fe2+
,负极Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的
正
正
极(填正或负),该电池的总反应为:2H2+O2=2H2O
2H2+O2=2H2O
.如图为原电池装置示意图.
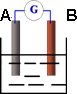
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为________,写出正极的电极反应式________.
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为________极
(填正或负),写出电极反应式:正极________负极________.
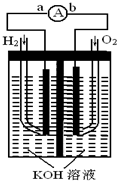 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是
化学能转变为电能
化学能转变为电能
,在导线中电子流动方向为由a到b
由a到b
(用a、b表示).(2)负极反应式为
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
.(3)电极表面镀铂粉的原因为
增大电极单位面积吸附H2、O2分子数?加快反应速率
增大电极单位面积吸附H2、O2分子数?加快反应速率
.(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是
Li
Li
,反应Ⅱ中的氧化剂是水
水
.②用锂吸收224L(标准状况)H2,生成的LiH与H2O作用后放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
32
32
mol.(5)肼一空气燃料电池是一种碱性电池,该电池放电时,肼作
负
负
极,其电极反应式为(生成无污染物质)N2H4-4e-+4OH-═N2+4H2O
N2H4-4e-+4OH-═N2+4H2O
.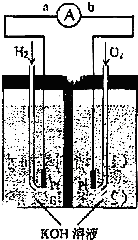 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:(1)氢氧燃料电池的能量转化主要形式是
(2)负极反应式为
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是
②已知LiH固体密度为 0.82g/cm3.用锂吸收 224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
![]()
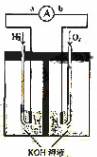
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
![]() (2)负极反应式为 。
(2)负极反应式为 。
![]() (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。
![]() (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w.k.s.5.u.c.o.m
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w.k.s.5.u.c.o.m
![]() Ⅰ.2Li+H2
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
![]() Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
![]() ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看习题详情和答案>>