网址:http://m.1010jiajiao.com/timu3_id_1242777[举报]
(12分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
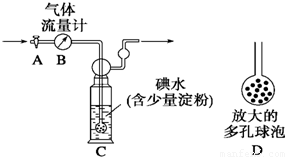
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
【乙方案】:实验步骤如下面流程图所示:
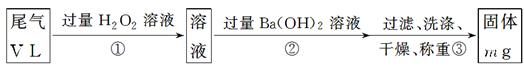
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式___________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是 .
_________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
查看习题详情和答案>>
(12分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
【乙方案】:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式___________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是 .
_________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
查看习题详情和答案>>
(12分)硫酸工业尾气中二氧化硫的含量超过0 .05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。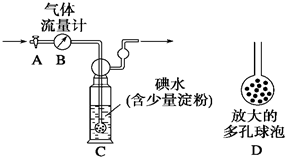
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
【乙方案】:实验步骤如下面流程图所示: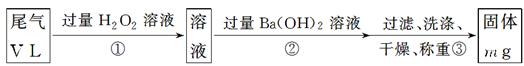
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式___________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是 .
_________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
右图是研究催化剂对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50ml量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量催化剂),记录各时间段收集到的氧气的体积。
实验一:以二氧化锰作催化剂,进行以下四组实验。
第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2O2
第2组:粉末状的二氧化锰0.2g+ 3ml 10% H2O2
第3组:粉末状的二氧化锰0.1g+5ml 6% H2O2
第4组:颗粒状的二氧化锰0.1g+5ml 6% H2O2
催化剂:MnO2 | 第1组 | 第2组 | 第3组 | 第4组 |
前15s产生氧气的量(ml) | 11 | 15 | 8 | 7 |
前30s产生氧气的量(ml) | 21 | 24 | 11 | 9 |
前45s产生氧气的量(ml) | 31 | 35 | 18 | 12 |
前60s产生氧气的量(ml) | 45 | 48 | 26 | 15 |
实验二:以不同的催化剂对过氧化氢(均为5ml 6% H2O2)分解反应速率影响进行研究,记录反应的时间t和相应的量筒内的气体体积读数V,用(V2―V1)/t作为反应速率的表达式(单位:ml?s-1),得到以下实验数据:
催化剂 | 产生气体速率/ ml?s-1 |
| 催化剂 | 产生气体速率/ ml?s-1 |
MnO2 | 0.03 |
| 土豆 | 0.03 |
CuO | 0.07 |
| 活性炭 | 0.12 |
(1) 写出H2O2分解的反应方程式
(2) 实验一的几组数据能说明
(3) 实验二的几组数据反映出
(4) 用碰撞理论解释催化剂能增大化学反应速率的原因
。
查看习题详情和答案>>