网址:http://m.1010jiajiao.com/timu3_id_1234616[举报]
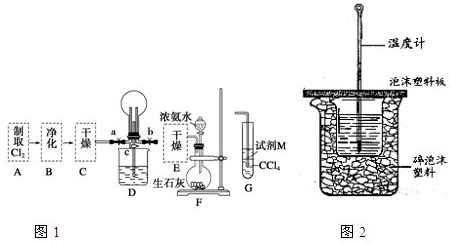
①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式
| ||
| ||
②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是
②使用补全仪器后的装置进行实验,取50mL 0.30mol/L H2SO4溶液与50mL 0.65mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=
③实验中若用60mL0.30mol?L-1H2SO4溶液跟50mL0.65mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热
(i)2C10H21(g)+20H2O(g)═20CO(g)+41H2(g)△H=+500kJ?moL-1
(ii)2C10H2l(g)+10O2(g)═20CO(g)+21H2(g)△H=-200kJ?moL-1
(iii)CO(g)+H2O(g)?CO2(g)+H2(g)△H=+50kJ?moL-1
请你参与项目小组的研究,并回答下列问题.
(1)热化学研究
①若要使该反应体系中的(i)和(ii)两反应热量达到平衡,反应时加入的柴油、水和氧气的物质的量比为
②若起始时,柴油、水和氧气的物质的量比为2:30:5,反应产物只有二氧化碳和氢气,则上述反应的总反应的热化学方程式为
(2)热力学研究
一定温度下,反应(iii)的平衡常数为1.若在该温度下,密闭容器中CO、H2O、CO2和H2的起始浓度分别为1mol?L-1、4mol?L-1、3mol?L-1、2mol?L-1,则反应开始时,此反应将向
(3)反应条件的实验研究
①为寻找上述反应的催化剂合适温度,进行了如下研究:将同物质的量比的柴油、水、氧气分别等量通人催化剂中,测得催化剂床层人口温度与反应生成混合气中氢气的体积分数的关系如图1.据此选择该反应较适宜的温度应为
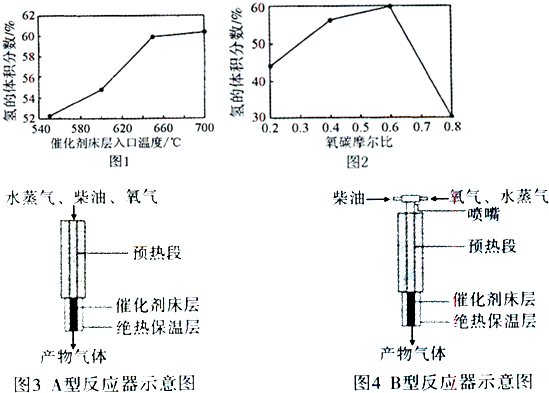
②实验中,项目小组得到如图2的实验结果,图中氧碳摩尔比是指通人的氧气中氧元素和柴油中碳元素的物质的量比.则此实验的目的是
③为比较图3和图4两种反应器的制氢效益,请设计一个实验方案(要求简单叙述实验方法和所需测定的数据).答:
I.某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图1:

①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式________,试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________.
②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为________,反应一段时间后,关闭b打开c,观察到的现象为________.
II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是________.
②使用补全仪器后的装置进行实验,取50mL 0.30mol/L H2SO4溶液与50mL 0.65mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=________,
③实验中若用60mL0.30mol?L-1H2SO4溶液跟50mL0.65mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热________ (填“相等”、“不相等”);若用50mL0.60mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会________ (填“偏大”、“偏小”、“不受影响”).
查看习题详情和答案>>
某化学实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(I)制取氧化铜
(1)称取2gCuSO45H2O在________(填仪器)中研细后倒入烧杯,加10mL蒸馏水溶解。
(2)向上述CuSO4溶液中逐滴加入NaOH溶液,立即产生蓝色沉淀,继续滴加,直到不再产生沉淀。然后将所得混合物转移到________(填仪器)中,加热至沉淀全部变为黑色,停止加热。
(3)将步骤(2)所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
①完成上面的空白。
②上述实验步骤中需要使用玻璃棒的是________(填实验序号)。
③步骤(3)中洗涤沉淀的操作是________
(Ⅱ)该小组同学从资料中得知氧化铜也能催化分解氯酸钾。他们为了比较氧化铜和氧化锰的催化效果,设计用右图装置进行实验,实验时均以生成25mL气体为准。其它可能影响实验的因素均已控制,相关数据见下表:


回答下列问题.
④上述实验中的待测数据指________
⑤若(5)(6)中待测数据分别为10和7(单位相同),则________(填写化学式)催化效果好。
⑥为探究CuO在实验(5)中是否起催化作用,需补做如下实验(无需写出具体操作):a________,b验证CuO的化学性质没有改变。
某化学实验兴趣小组在“探究氯水与溴化亚铁溶液反应”的实验中发现:“在足量的溴化亚铁溶液中,加入1~2滴氯水,振荡后溶液呈黄色。”
| 【资料】 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色。 |
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
溶液呈黄色是因发生离子反应① (填离子方程式)所致。
溶液呈黄色是因发生离子反应② (填离子方程式)所致。
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验。请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加 并振荡 | 溶液变红色 | 反应 所致 |
| 2 | 取所述黄色溶液于试管中,滴加 并振荡 | ________ ________ |
(3)实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br- (填“强”或“弱”)。
(4)实验反思
I. 根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是 。
Ⅱ. 在100 mLFeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
查看习题详情和答案>>