网址:http://m.1010jiajiao.com/timu3_id_1232099[举报]
 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.①2CO2(g)+6H2(g)
| 催化剂 |
②2CO(g)+4H2(g)
| 催化剂 |
(1)写出反应①的平衡常数表达式K=
(2)条件相同时,反应①与反应②相比,转化程度更大的是
(3)在一定压强下,测得反应①的实验数据如下表.
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
(4)在如图的坐标系中作图说明压强变化对反应①的化学平衡的影响,并标明横坐标、纵坐标的含义.
①2CO2(g)+6H2(g)
| 催化剂 |
②2CO(g)+4H2(g)
| 催化剂 |
(1)写出反应①的平衡常数表达式K=______.
(2)条件相同时,反应①与反应②相比,转化程度更大的是______;以CO2为原料合成乙醇的优点是______(写出一条即可).
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
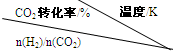 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”).
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:______.
①2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 ②2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022 (1)写出反应①的平衡常数表达式K=____________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________________;以CO2为原料合成乙醇的优点是________________(写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题
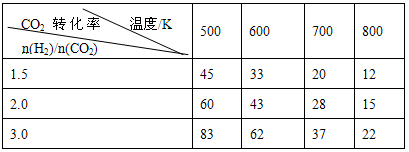
②提高氢碳比[n(H2)/n(CO2)],K值________ (填“增大”、“减小”、或“不变”),对生成乙醇________(填“有利”或“不利”)。
(4)在下图的坐标系中作图说明压强变化对反应①的化学平衡的影响。并对图中横坐标、纵坐标的含义作必要的标注。
已知:N2(g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= -534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为________________。
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4 H2(g) ![]() CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
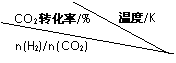 | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= ―534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
查看习题详情和答案>>乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
![]() ①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
![]() ②2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
②2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
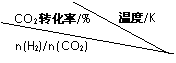 (3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
| 500 | 600 | 700 | 800 | |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
 ②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= —534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
查看习题详情和答案>>