网址:http://m.1010jiajiao.com/timu3_id_1231457[举报]
【化学——物质结构与性质】13分)
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
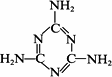
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
查看习题详情和答案>>
【化学——物质结构与性质】13分)
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
查看习题详情和答案>>
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||