摘要:27.A.B.C.D.E是中学化学常见的五种单质.已知A.B.C.D在常温下均为气态.其中D能分别跟A.B.C在一定条件下两两化合.生成化合物X.Y.Z,A与B.C均不能直接化合.有关的转化关系如下图所示. 回答下列问题: (1)A的化学式为 , (2)写出反应③的化学反应方程式 , (3)Z和W在催化剂作用下反应生成C和Y.这是一个很有实际意义的反应.可以消除W对环境的污染.该反应的化学方程式为 , (4)将过量的E加到N的稀溶液中.若过程中转移电子的数目为3.01×1023.则参加反应的E的质量为 g, (5)将Z与N反应后的产物溶于水中.则溶液的pH(填“< 或“> 7.其原因是 .
网址:http://m.1010jiajiao.com/timu3_id_1230284[举报]
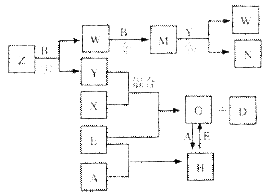 A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
(1)化合物Z的空间构型为 ;构成A的元素的最高价氧化物水化物的化学式为 ;实验室贮存N的方法是 。
(2)写出反应②的化学反应方程式 ;G→H的离子方程式 。
(3)常温下,D与A反应生成1 mol X时放热92.3kJ,写出该反应的热化学方程式:
。
(4)将过量的E加入N的稀溶液中,若反应过程中转移电子的数目为3.01×1023,则参加反应的E的质量为 g。
查看习题详情和答案>>A、B、C、 D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表:

(1)E元素基态原子的电子排布式是________________。
(2)在一定条件下,B与D可形成一种化合物(分子中每个原子最外层均为8电子结构),常温下为淡黄色液体,该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:____________________ 。
(3)E单质在海水中易发生电化学腐蚀,写出该电化学腐蚀的正极电极反应式:___________________。
(4)已知1 g单质C完全燃烧放出热量为Q kJ,写出表示C 燃烧热的热化学方程式:___________________。
(5)A与D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是________________(填“σ键”或“π键”)。
查看习题详情和答案>>
(2)在一定条件下,B与D可形成一种化合物(分子中每个原子最外层均为8电子结构),常温下为淡黄色液体,该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:____________________ 。
(3)E单质在海水中易发生电化学腐蚀,写出该电化学腐蚀的正极电极反应式:___________________。
(4)已知1 g单质C完全燃烧放出热量为Q kJ,写出表示C 燃烧热的热化学方程式:___________________。
(5)A与D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是________________(填“σ键”或“π键”)。
A、B、C、D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表

(1)五种元素的符号依次是A________B________C________D________E________。
(2)E元素基态原子的电子排布式是________________________。
(3)在一定条件下,B与D可形成一种化合物 (分子中每个原子最外层均为8电子结构),常温下为淡黄色液体,该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:________________________。
(4)己知1克单质C完全燃烧放出热量为QkJ,写出表示C燃烧的热化学方程式_____________________。
(5)比较A与C的电负性:A________C (填<,=或>)
查看习题详情和答案>>
(2)E元素基态原子的电子排布式是________________________。
(3)在一定条件下,B与D可形成一种化合物 (分子中每个原子最外层均为8电子结构),常温下为淡黄色液体,该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:________________________。
(4)己知1克单质C完全燃烧放出热量为QkJ,写出表示C燃烧的热化学方程式_____________________。
(5)比较A与C的电负性:A________C (填<,=或>)
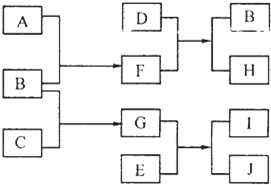 A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);
A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);请回答下列问题:
(1)元素B在周期表的位置是
(2)写出D与F反应的化学方程式:
(3)H是一种典型的
(4)若参加反应的E足量,生成的J中含有组成B的元素,则检验化合物J中阳离子的化学方法(有必要的文字叙述和相应的离子方程式)是:
已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质.若在常温下将气体D通入水中可以发生反应,生成C和E.工业上以A、空气和水为原料,通过催化氧化法制取E.请回答以下问题:
(1)A分子的空间构型为
(2)写出气体D通入水中的化学反应方程式
(3)E具有不稳定性,因此实验室中保存E的方法是
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式:
查看习题详情和答案>>
(1)A分子的空间构型为
三角锥形
三角锥形
;Y在周期表中的位置第二周期第VA族
第二周期第VA族
;(2)写出气体D通入水中的化学反应方程式
3NO2+H2O=NO+2HNO3
3NO2+H2O=NO+2HNO3
;(3)E具有不稳定性,因此实验室中保存E的方法是
贮存在棕色瓶中,置于冷暗处
贮存在棕色瓶中,置于冷暗处
;(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式:
8NH3+3Cl2=6NH4Cl+N2
8NH3+3Cl2=6NH4Cl+N2
,当反应中转移的电子为3mol时,被氧化的A在标准状况下的体积为22.4L
22.4L
L.