摘要:25.用图1所示的Ⅰ和Ⅱ装置组合与Ⅰ和Ⅲ装置组合可以进行相关实验.回答下列问题: 图1 (1)若用Ⅰ和Ⅱ装置或Ⅰ和Ⅲ装置 组合.实验前检查装置气密性 的方法是 . (2)在Ⅰ和Ⅱ装置组合中.若a为浓 硫酸.b为铜粉.c容器中盛放 品红溶液.旋开f后.给烧瓶加 热.一段时间后c中的现象是 . 写出烧瓶中发生反应的化学方程 式 . (3)在Ⅰ装置中.若a为浓氨水.b为生石灰.欲制取氨气并证明氨水有碱性.最好应选用 装置与其组合.原因是 . (4)在Ⅰ装置中.若a为可能含有Mg2+. Cu2+.Al3+.Fe3+四种阳离子的水 溶液.b为过氧化钠固体.旋开f后. 有白色沉淀产生并放出氧气.过氧 化钠固体的物质的量与产生沉淀的 质量关系如图2.则a溶液中含有的 阳离子有 . 其阳离子的物质的量浓度之比为 . (5)在图2A→B段反应过程中溶液所 增加的阴离子是 .
网址:http://m.1010jiajiao.com/timu3_id_1229508[举报]
如图1所示是实验室制取氧气的装置图,请按要求回答下列问题.
(1)写出图中标号仪器的名称:①
(2)实验室用氯酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是
(3)实验室用H2O2溶液和MnO2混合制氧气,该反应的化学方程式为
(4)若用如图所示医用塑料袋排空气法收集H2,则H2导入端为
(5)用图2中I所示的矿泉水瓶进行对比实验,可以证明CO2与NaOH溶液确实发生了反应,应作的对比实验是
查看习题详情和答案>>

(1)写出图中标号仪器的名称:①
酒精灯
酒精灯
.(2)实验室用氯酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是
AE
AE
(填字母序号,下同).(3)实验室用H2O2溶液和MnO2混合制氧气,该反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.同学们利用B和F装置,通过排水量来测定生成氧气的体积,反应结束后,发现量筒内收集到的水的体积总是比理论值偏大(水的体积测量准确),其主要原因是
| ||
从分液漏斗流下的双氧水占有一定的体积
从分液漏斗流下的双氧水占有一定的体积
.(4)若用如图所示医用塑料袋排空气法收集H2,则H2导入端为
b
b
(填“a”或“b”)(5)用图2中I所示的矿泉水瓶进行对比实验,可以证明CO2与NaOH溶液确实发生了反应,应作的对比实验是
将氢氧化钠溶液溶液换成等体积的蒸馏水作对比实验
将氢氧化钠溶液溶液换成等体积的蒸馏水作对比实验
.CO2与NaOH溶液反应的化学方程式为CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
.如图1所示是实验室制取氧气的装置图,请按要求回答下列问题.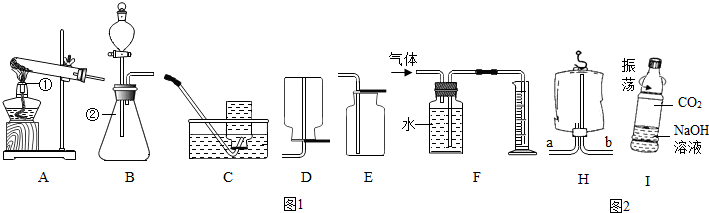
(1)写出图中标号仪器的名称:①______.
(2)实验室用氯酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是______(填字母序号,下同).
(3)实验室用H2O2溶液和MnO2混合制氧气,该反应的化学方程式为______.同学们利用B和F装置,通过排水量来测定生成氧气的体积,反应结束后,发现量筒内收集到的水的体积总是比理论值偏大(水的体积测量准确),其主要原因是______.
(4)若用如图所示医用塑料袋排空气法收集H2,则H2导入端为______(填“a”或“b”)
(5)用图2中I所示的矿泉水瓶进行对比实验,可以证明CO2与NaOH溶液确实发生了反应,应作的对比实验是______.CO2与NaOH溶液反应的化学方程式为______.
查看习题详情和答案>>
图1是实验室常用的装置,请回答下列问题:

(1)写出仪器①的名称 .收集某气体能采用E装置,由此推测该气体具有的性质是 .
(2)实验室制备并收集氧气的装置组合是 (填装置序号),反应的化学方程式为 ;若用F装置收集该气体,则气体应从 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是 .
(3)实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项字母编号).
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有 ,B处发生反应的化学方程式是 .
(5)实验室制取氧气时常用二氧化锰作催化剂.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.
①如图3所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是 .
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入 装置进行证明.
③现称取5.0g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程) 查看习题详情和答案>>

(1)写出仪器①的名称 .收集某气体能采用E装置,由此推测该气体具有的性质是 .
(2)实验室制备并收集氧气的装置组合是 (填装置序号),反应的化学方程式为 ;若用F装置收集该气体,则气体应从 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是 .
(3)实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项字母编号).
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有 ,B处发生反应的化学方程式是 .
(5)实验室制取氧气时常用二氧化锰作催化剂.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.
①如图3所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是 .
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入 装置进行证明.
③现称取5.0g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程) 查看习题详情和答案>>
