摘要:27. 某化学研究性学习小组为探究元素性质的变化规律.设计了如下实验: (1)甲同学根据同周期元素原子结构的变化规律.预测出同一周期.从左至右元素的 金属性逐渐减弱.请你根据实验室常用试剂利仪器帮助甲同学设计实验.简述实验步骤 和现象: . (2)乙同学欲比较N.C.Si的非金属性强弱.设计了图1所示的实验装置.其能否达 到实验目的 .设计的理论依据是 . 但也有同学根据硝酸具有挥发性.认为乙同学的实验装置存在不足.请你帮助该同学提 出修改意见 . (3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线 位置的某些元 素性质相似.预测金属铍应该具有与 相似的性质.能证明其预测的实验方案 是 . (4)丁同学设计了如图2装置验证元素性质递变规律.A.B.C处分别是蘸有NaBr 溶液的棉花.湿润的淀粉KI试纸.湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应 生成氯气.丁同学可能观察到的现象有 . 从环保 角度考虑.该装置有明显不足.请指出并提出改进建议 .
网址:http://m.1010jiajiao.com/timu3_id_1229122[举报]
某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
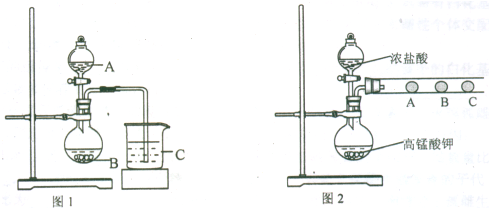
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.
查看习题详情和答案>>
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.

某化学研究性学习小组为探究元素性质的变化规律,设计了如下实验:
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.

查看习题详情和答案>>
(1)甲同学根据同周期元素原子结构的变化规律,预测出同一周期,从左至右元素的金属性逐渐减弱.请你根据实验室常用试剂和仪器帮助甲同学设计实验,简述实验步骤和现象(以第三周期元素为例):______.
(2)乙同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其能否达到实验目的______(填“能”或“不能”),设计的理论依据是______. 但也有同学根据硝酸具有挥发性,认为乙同学的实验装置存在不足,请你帮助该同学提出修改意见______.
(3)丙同学从资料中获悉:元素周期表中处于象硼与硅这样“对角线”位置的某些元素性质相似.预测金属铍应该具有与______相似的性质,能证明其预测的实验方案是______.
(4)丁同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.丁同学可能观察到的现象有______. 从环保角度考虑,该装置有明显不足,请指出并提出改进建议______.

查看习题详情和答案>>
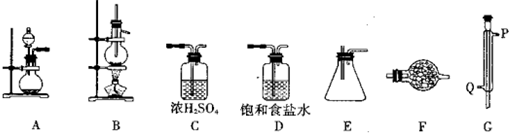
某化学研究性学习小组为了探究四氯化锡的有关性质,拟先利用下列装置和药品进行四氯化锡的制备.已知四氯化锡具有强的吸水性,SnCl4和Sn的部分数据如下
供选择的药品:Sn、浓HC1、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰仪器装置:
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→______→______→______→______→______→______;
(2)仪器G的名称是______;实验时,G中冷却水的流向是从______进入(填符号);
(3)A中发生反应的离子方程式为______;
(4)F中盛装的化学试剂是______;其作用是______;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示)______.
查看习题详情和答案>>
| 密度 | 熔点 | 沸点 | |
| 四氯化锡 | 2.2g?cm-3 | -33℃ | 114℃ |
| 金属锡 | 5.77g?cm-3 | 231℃ |

请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→______→______→______→______→______→______;
(2)仪器G的名称是______;实验时,G中冷却水的流向是从______进入(填符号);
(3)A中发生反应的离子方程式为______;
(4)F中盛装的化学试剂是______;其作用是______;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示)______.
某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:
I.向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.学生甲认为此补血剂含铁量很低,属不合格产品.
(1)你认为学生甲的观点合理吗?
II.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为
(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因
(4)请写出加入氯水后对应的离子反应方程式
(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成
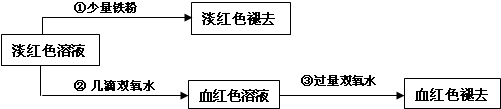
III.学生丙也做了与学生甲同样的实验,将所得的淡红色溶液分成两份继续进行实验:
试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式
(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了.请你设计一个实验方案验证丙的假设
查看习题详情和答案>>
I.向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.学生甲认为此补血剂含铁量很低,属不合格产品.
(1)你认为学生甲的观点合理吗?
不合理
不合理
II.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为
+2
+2
价.(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因
有少量的亚铁离子被氧化.
有少量的亚铁离子被氧化.
.(4)请写出加入氯水后对应的离子反应方程式
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成
+3
+3
价铁,而Fe与I2反应的产物应该是FeI2
FeI2
.III.学生丙也做了与学生甲同样的实验,将所得的淡红色溶液分成两份继续进行实验:

试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了.请你设计一个实验方案验证丙的假设
取少量加入过量双氧水后的溶液,往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了
取少量加入过量双氧水后的溶液,往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了
.某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色.
(1)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因是:
(2)学生甲认为此补血剂含铁量很低,属不合格产品.你认为学生甲的观点合理吗?为什么?
(3)学生乙又作了进一步探究实验,他将上述所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请写出加入氯水后对应的离子反应方程式
(4)请根据乙同学的实验现象进一步推断,Fe与I2反应的产物应该是
查看习题详情和答案>>
(1)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因是:
有少量的亚铁离子被氧化
有少量的亚铁离子被氧化
.(2)学生甲认为此补血剂含铁量很低,属不合格产品.你认为学生甲的观点合理吗?为什么?
不合理
不合理
(3)学生乙又作了进一步探究实验,他将上述所得溶液分成三份,分别加入了氯水、溴水、碘水.发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化.请写出加入氯水后对应的离子反应方程式
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.(4)请根据乙同学的实验现象进一步推断,Fe与I2反应的产物应该是
FeI2
FeI2
.