摘要:(1)常温反应.不需加热反应速率快 (3)便于回收二氧化锰 (4)制得的氧气纯净
网址:http://m.1010jiajiao.com/timu3_id_120778[举报]
根据如图所示实验装置回答问题:
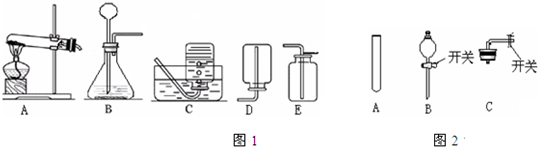
(1)小明同学选择A装置准备用高锰酸钾为原料制取一瓶纯净的氧气(不考虑水蒸气),他应选择的收集装置是
(2)小华同学想用过氧化氢溶液和二氧化锰为原料代替高锰酸钾用排气法制取收集一瓶氧气,她选择的发生装置是
(3)当过氧化氢接触到二氧化锰后,反应便立即开始,不能人为控制其速度和生成氧气的量.如果你稍改变所选择装置,便易于控制.请从图2的仪器中选择一种仪器更换小华同学选择的装置中一种仪器,以达到控制反应的目的,你选择的仪器是
②若实验室对你开放,图1实验装置还可制取
查看习题详情和答案>>

(1)小明同学选择A装置准备用高锰酸钾为原料制取一瓶纯净的氧气(不考虑水蒸气),他应选择的收集装置是
C
C
(填字母),写出该方法制取氧气的化学反应方程式2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(2)小华同学想用过氧化氢溶液和二氧化锰为原料代替高锰酸钾用排气法制取收集一瓶氧气,她选择的发生装置是
B
B
(填字母),理由是过氧化氢是液体、二氧化锰是固体,反应不要加热
过氧化氢是液体、二氧化锰是固体,反应不要加热
. 收集装置是E
E
(填字母).(3)当过氧化氢接触到二氧化锰后,反应便立即开始,不能人为控制其速度和生成氧气的量.如果你稍改变所选择装置,便易于控制.请从图2的仪器中选择一种仪器更换小华同学选择的装置中一种仪器,以达到控制反应的目的,你选择的仪器是
B
B
(填序号),它更换原装置中的长颈漏斗
长颈漏斗
(填名称).你认为以上小明和小华制取氧气的方法那一种更好,小华
小华
,理由是反应在常温下进行节约能源;操作简便
反应在常温下进行节约能源;操作简便
(写两点).②若实验室对你开放,图1实验装置还可制取
二氧化碳或CO2
二氧化碳或CO2
气体,你还需向实验老师领取的药品有大理石或石灰石,稀盐酸
大理石或石灰石,稀盐酸
(写名称)其反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
. 燃烧是一种发光、发热的剧烈的化学反应.认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的.下面是验证燃烧条件的实验装置图.
燃烧是一种发光、发热的剧烈的化学反应.认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的.下面是验证燃烧条件的实验装置图.(1)简要叙述检验该装置气密性的方法
关闭分液漏斗活塞,用手焐热装置A(或用酒精灯微热平行试管),若C中导管口生成气泡,则装置气密性良好.(或由分液漏斗向A中缓缓注水,若C中导管口生成气泡,则装置气密性良好.)
关闭分液漏斗活塞,用手焐热装置A(或用酒精灯微热平行试管),若C中导管口生成气泡,则装置气密性良好.(或由分液漏斗向A中缓缓注水,若C中导管口生成气泡,则装置气密性良好.)
.(2)请验证:木炭发生燃烧的另外两个条件中,只有同时具备这两个条件才能燃烧(两个条件须分别验证).
在完成气密性检查后填装药品,并已设法在整个装置中充满了氮气.若要求实验过程中不得拆、装仪器,请设计后续的实验步骤,并按要求填表.
| 步骤 | 操 作 | 预计现象及得出的结论 |
| ① | 点燃酒精灯加热 | |
| ② | 熄灭酒精灯,待仪器恢复至常温 | C试管长导管内有一段水柱 |
| ③ | 打开分液漏斗旋塞,通入氧气一段 时间 |
|
| ④ | 木炭燃烧,澄清石灰水变浑浊,说明燃烧 需同时满足有充足氧气与温度达到着火点两个条件 |
A中气体压强过大,胶塞冲出
A中气体压强过大,胶塞冲出
.②又有人建议在实验开始后,在Y管末端处增添一个燃着的酒精灯,这样做的好处是
2CO+O2
2CO2
| ||
2CO+O2
2CO2
(用化学方程式表示).
| ||
③装置B在“盖灭酒精灯,待仪器恢复到常温”这一步中的作用是
防止因石灰水倒吸而使平行试管破裂
防止因石灰水倒吸而使平行试管破裂
.54、过去教材中实验室制氧气,常用氯酸钾与二氧化锰混合加热制取,从预热到收集满一瓶(250mL)氧气大约需8~10分钟,从反应后剩余的固体中回收二氧化锰比较困难,曾有同学去闻自己收集到的氧气,想找找吸氧的感觉,结果却闻到刺激性气味(少量氯酸钾发生副反应生成有毒的氯气).现行教材已改用过氧化氢溶液和二氧化锰混合制取氧气,你认为这样做的优点都有哪些?
(1)
(3)
查看习题详情和答案>>
(1)
常温反应,不需加热(或操作简便)
;(2)反应速率快
;(3)
便于回收二氧化锰
;(4)制得的氧气纯净(或无污染)
.实验室常用下列装置来制取气体:
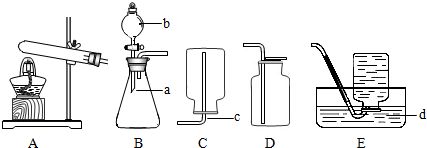
(1)写出图中标号仪器的名称:a
(2)装置B中使用仪器b具有的优点是
(3)用双氧水和二氧化锰来制取氧气时,应选用的发生装置是
(4)实验室若用高锰酸钾来制备氧气,则应选用的发生装置是
(5)上述两种方法都能用于实验室制备氧气,你认为其中相对较好的方法是
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水.制取氨气反应的文字表达式:氯化铵+熟石灰 氯化钙+氨气+水.则制取并收集氨气,应该从上图中选择的发生装置是(
(6)“化学反应条件的控制是实验的灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水(过氧化氢溶液)分解因素”的探究实验.下表是该化学兴趣小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(秒)
请你分析回答:
①该研究小组在设计方案时.考虑了浓度、
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
查看习题详情和答案>>

(1)写出图中标号仪器的名称:a
锥形瓶
锥形瓶
b分液漏斗
分液漏斗
;c导管
导管
;d水槽
水槽
;(2)装置B中使用仪器b具有的优点是
反应随开随关
反应随开随关
;若要检查该装置的气密性,应如何操作在导管上接乳胶管并用弹簧夹夹紧,向分液漏斗内不断加水,一段时间后分液漏斗内液面不在下降,则气密性良好
在导管上接乳胶管并用弹簧夹夹紧,向分液漏斗内不断加水,一段时间后分液漏斗内液面不在下降,则气密性良好
.(3)用双氧水和二氧化锰来制取氧气时,应选用的发生装置是
B
B
(填序号),该反应的符号表达式为:2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,二氧化锰是该反应的
| ||
催化剂
催化剂
.(4)实验室若用高锰酸钾来制备氧气,则应选用的发生装置是
A
A
(填序号),该反应的符号表达式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
;此反应中二氧化锰是作为
| ||
生成物
生成物
.要获得干燥的氧气,应选用的收集装置是D
D
.(5)上述两种方法都能用于实验室制备氧气,你认为其中相对较好的方法是
用双氧水和二氧化锰来制取氧气
用双氧水和二氧化锰来制取氧气
,其理由是不需加热,操作简便
不需加热,操作简便
.(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气.常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水.制取氨气反应的文字表达式:氯化铵+熟石灰 氯化钙+氨气+水.则制取并收集氨气,应该从上图中选择的发生装置是(
A
A
(填序号,下同),收集装置是C
C
.(6)“化学反应条件的控制是实验的灵魂”.某校化学兴趣小组在老师指导下,进行了“影响双氧水(过氧化氢溶液)分解因素”的探究实验.下表是该化学兴趣小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(秒)
| 反应条件\浓度 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时.考虑了浓度、
温度
温度
、催化剂
催化剂
等因素对过氧化氢分解速率的影响.②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
温度越高,过氧化氢的分解速率越快(或过氧化氢浓度越高,过氧化氢的分解速率越快或使用催化剂,过氧化氢的分解速率越快)
温度越高,过氧化氢的分解速率越快(或过氧化氢浓度越高,过氧化氢的分解速率越快或使用催化剂,过氧化氢的分解速率越快)
.请根据下列装置,回答问题:
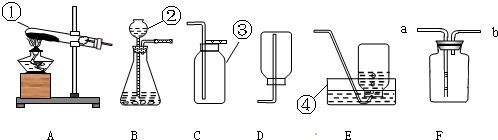
(1)写出指定仪器的名称:①
(2)如果要用双氧水和二氧化锰混合制取并收集一瓶干燥的氧气,通常可选用上述装置中的
(3)实验室收集较纯净的O2,可选用收集装置是
(4)实验室用双氧水制取氧气与用高锰酸钾加热制取氧气从反应原理角度
优点是
(5)实验室常用氯化铵固体与碱石灰固体加热来制取氨气.常温下NH3是一种无色、有刺激性气味的气体,密度比空气小.NH3极易溶于水,其水溶液呈碱性.现选择合适的装置来制取并收集NH3,应该选择的发生装置是
查看习题详情和答案>>

(1)写出指定仪器的名称:①
试管
试管
②长颈漏斗
长颈漏斗
③集气瓶
集气瓶
④水槽
水槽
(2)如果要用双氧水和二氧化锰混合制取并收集一瓶干燥的氧气,通常可选用上述装置中的
BCF
BCF
(填写装置序号);(3)实验室收集较纯净的O2,可选用收集装置是
E
E
(填写装置序号).如果某同学用F收集一瓶氧气,则收集时气体应从导管口的a
a
端(填“a”或“b”)通入,用C装置收集O2,判断O2已收集满的方法是将带火星的木条放于瓶口,木条复燃则满
将带火星的木条放于瓶口,木条复燃则满
.(4)实验室用双氧水制取氧气与用高锰酸钾加热制取氧气从反应原理角度
优点是
不需加热,节约能源
不需加热,节约能源
,操作简便(合理均可)
操作简便(合理均可)
(写两点)(5)实验室常用氯化铵固体与碱石灰固体加热来制取氨气.常温下NH3是一种无色、有刺激性气味的气体,密度比空气小.NH3极易溶于水,其水溶液呈碱性.现选择合适的装置来制取并收集NH3,应该选择的发生装置是
A
A
,收集装置是D
D
(填装置序号)我认为选择气体收集方法,从气体性质的角度需要考虑的因素是:气体的密度及是否与空气中某些气体反应
气体的密度及是否与空气中某些气体反应
,气体的溶解性及是否与水反应
气体的溶解性及是否与水反应
.