摘要:测定空气中氧气含量的原理:按课本中图2-3进行实验.红磷燃烧消耗集气瓶中的气体.使集气瓶中气体压强减少.冷却后打开弹簧夹.烧杯中的水进入集气瓶中.最后进入集气瓶的水的体积就是红磷燃烧消耗气体的体积.反应的文字表达式:红磷+氧气五氧化二磷 结论:空气的组成不是单一的.氧气约占空气体积的1/5. (3)红磷不足.容器内温度还未冷却至室温就读数
网址:http://m.1010jiajiao.com/timu3_id_120702[举报]
某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验(如图甲所示),但测出的氧气的体积分数明显小于
.
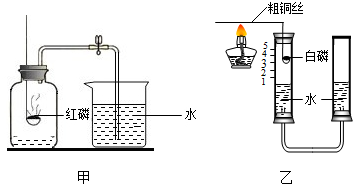
请你参与探究:?
【提出问题】造成误差的原因是什么?如何改进课本上的实验装置??
【查阅资料】红磷、白磷的一些性质如下表:?
【猜想与假设】?
甲同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性.
乙同学:可能是瓶内残留气体中还有氧气.?
你还能作出的猜想是 .
【交流与讨论】
(1)丙同学认为用木炭代替红磷,就可以消除误差,大家认为他的猜想不合理,理由是 .
(2)他们对课本上的实验装置进行了图乙所示的改进(其他仪器忽略).
①甲同学提出应把红磷换为白磷,理由是 .
②通过粗铜丝来点燃玻璃管内的白磷,这利用了金属铜的 性.?
③与课本上的实验装置相比较,该装置的一个优点是 .
【探究与反思】?
(1)为了验证乙同学的猜想,将铜粉放在残余气体中加热,观察到铜粉变黑色,证明乙同学的猜想 (填“合理”或“不合理”).?
(2)大家用改进的实验装置(如图乙所示)进行实验,待玻璃管冷却、管内白色的烟幕消失时,左玻璃管内的液面上升了1格,得到了较准确的结果,但又意外发现左玻璃管内壁上端附着黄色固体.
①左玻璃管上端的黄色固体的主要成分可能是 ;?
②集气瓶放入少量水,目的是 .
查看习题详情和答案>>
| 1 |
| 5 |

请你参与探究:?
【提出问题】造成误差的原因是什么?如何改进课本上的实验装置??
【查阅资料】红磷、白磷的一些性质如下表:?
| 颜色、状态 | 熔点/℃ | 着火点/℃ | 密度(g/cm3) | |
| 红磷 | 暗红色固体 | 590 | 240 | 2.34 |
| 白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
甲同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性.
乙同学:可能是瓶内残留气体中还有氧气.?
你还能作出的猜想是
【交流与讨论】
(1)丙同学认为用木炭代替红磷,就可以消除误差,大家认为他的猜想不合理,理由是
(2)他们对课本上的实验装置进行了图乙所示的改进(其他仪器忽略).
①甲同学提出应把红磷换为白磷,理由是
②通过粗铜丝来点燃玻璃管内的白磷,这利用了金属铜的
③与课本上的实验装置相比较,该装置的一个优点是
【探究与反思】?
(1)为了验证乙同学的猜想,将铜粉放在残余气体中加热,观察到铜粉变黑色,证明乙同学的猜想
(2)大家用改进的实验装置(如图乙所示)进行实验,待玻璃管冷却、管内白色的烟幕消失时,左玻璃管内的液面上升了1格,得到了较准确的结果,但又意外发现左玻璃管内壁上端附着黄色固体.
①左玻璃管上端的黄色固体的主要成分可能是
②集气瓶放入少量水,目的是
(2012?高淳县二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.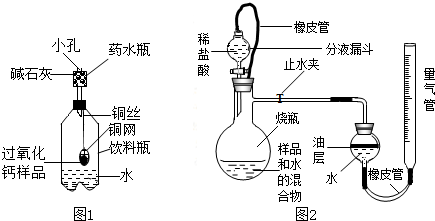
过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?【猜想】另一生成物为氢氧化钙.
【进行试验】取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
写出该反应的化学方程式
【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,你认为褪色的可能原因是
【查阅资料】过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质.
实验探究二:测定久置过氧化钙纯
【实验过程】
称量144g样品放在铜网中,按图1装置组装后 (药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器及反应后物质总质量.测得实验数据如下表.
【问题讨论】
(1)药水瓶中碱石灰的作用为
(2)本实验测得过氧化钙含量可能会偏小的原因是
(3)根据实验数据计算:
①生成氧气
②样品中过氧化钙的含量是
实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性合格;
②称量20g样品置于烧杯中,加入适量水混合,完全反应后全部倒入下图的烧瓶中,向分液漏斗中加入足量稀盐酸待用;
③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管内液面与油层液面相平,读出气体体积;
⑤查得CO2的密度,计算样品中碳酸钙的质量分数.
(4)图中油层的作用为
(5)反应结束后,测得量气管读数为1120ml,根据该条件下CO2的密度得知生成CO2的质量为2.2g.求样品中碳酸钙的质量分数(写出计算过程).
(6)步骤④中再次调节量气管内液面与油层液面相平的方法
(7)充分反应后将烧瓶中的液体蒸干,得到27.75g固体,这袋样品在变质前全为过氧化钙,其质量为
查看习题详情和答案>>

过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?【猜想】另一生成物为氢氧化钙.
【进行试验】取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
红
红
色,则猜想成立. 写出该反应的化学方程式
2CaO2+2H2O=2Ca(OH)2+O2↑
2CaO2+2H2O=2Ca(OH)2+O2↑
.【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,你认为褪色的可能原因是
Ca(OH)2被空气中的二氧化碳反应掉了
Ca(OH)2被空气中的二氧化碳反应掉了
.【查阅资料】过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质.
实验探究二:测定久置过氧化钙纯
【实验过程】
称量144g样品放在铜网中,按图1装置组装后 (药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器及反应后物质总质量.测得实验数据如下表.
| 样品 质量 |
装置及药品 总质量 |
装置及反应后物质 总质量 | |
| 实验数据 | 144g | 394g | 378g |
(1)药水瓶中碱石灰的作用为
吸收O2中的水蒸气
吸收O2中的水蒸气
.(2)本实验测得过氧化钙含量可能会偏小的原因是
生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
.(3)根据实验数据计算:
①生成氧气
16
16
g.②样品中过氧化钙的含量是
72
72
g.实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性合格;
②称量20g样品置于烧杯中,加入适量水混合,完全反应后全部倒入下图的烧瓶中,向分液漏斗中加入足量稀盐酸待用;
③将量气管液面调节到“0”刻度,并使量气管内液面与油层相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管内液面与油层液面相平,读出气体体积;
⑤查得CO2的密度,计算样品中碳酸钙的质量分数.
上下移动量气管,至量气管内的液面与油层液面相平
上下移动量气管,至量气管内的液面与油层液面相平
(4)图中油层的作用为
隔绝水和CO2,防止CO2溶于水
隔绝水和CO2,防止CO2溶于水
,油层上方留有空气,会使测量结果不受影响
不受影响
(填“偏大”、“偏小”或“不受影响”).中和反应明显放出热量,滴加稀盐酸后,发生装置里发生的中和反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
,这个反应的发生可能使测定结果偏大
偏大
(填“偏大”、“偏小”或“不受影响”).(5)反应结束后,测得量气管读数为1120ml,根据该条件下CO2的密度得知生成CO2的质量为2.2g.求样品中碳酸钙的质量分数(写出计算过程).
设碳酸钙的质量分数为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
20g?y 2.2g
=
y=25%
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
20g?y 2.2g
| 100 |
| 20g?y |
| 44 |
| 2.2g |
y=25%
设碳酸钙的质量分数为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
20g?y 2.2g
=
y=25%
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
20g?y 2.2g
| 100 |
| 20g?y |
| 44 |
| 2.2g |
y=25%
(6)步骤④中再次调节量气管内液面与油层液面相平的方法
上下移动量气管,至量气管内的液面与油层液面相平
上下移动量气管,至量气管内的液面与油层液面相平
.步骤②中将样品和水混合的目的是除去CaO2,防止在烧瓶中产生氧气
除去CaO2,防止在烧瓶中产生氧气
.(7)充分反应后将烧瓶中的液体蒸干,得到27.75g固体,这袋样品在变质前全为过氧化钙,其质量为
18
18
g.
刘敏同学选用下图中的仪器组装成实验室制取气体的两种发生装置.
(1)第一种装置所需的仪器有______(填写其他仪器的序号).
用这种装置制取氧气的操作过程中,用排水法收集氧气完成后,接下来的操作应是先______,然后再______.
第二种装置所需的仪器有______(填写其他仪器的序号).
实验室制取二氧化碳气体的发生装置应采用第______种装置,用该装置制取二氧化碳的反应原理(化学方程式)是______.
(2)为了测定能使带火星的木条复燃时氧气的最低含量是多少,课外活动小组的同学们进行了实验探究.他们设计的实验方案是先将氧气和空气按不同的体积比收集在集气瓶里.收集气体的装置如右图.
收集气体的方法是:在150mL集气瓶里装满水,塞紧胶塞并关闭活塞b,打开活塞a通入氧气,把瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把瓶里的水全部排入量筒.
若要收集一瓶含氧气的体积分数约为60%的气体,则停止通入氧气时量筒内水的体积约为______(选填序号).
A.75 mLB.60 mLC.40 mLD.25 mL.
 查看习题详情和答案>>
查看习题详情和答案>>

(1)第一种装置所需的仪器有______(填写其他仪器的序号).
用这种装置制取氧气的操作过程中,用排水法收集氧气完成后,接下来的操作应是先______,然后再______.
第二种装置所需的仪器有______(填写其他仪器的序号).
实验室制取二氧化碳气体的发生装置应采用第______种装置,用该装置制取二氧化碳的反应原理(化学方程式)是______.
(2)为了测定能使带火星的木条复燃时氧气的最低含量是多少,课外活动小组的同学们进行了实验探究.他们设计的实验方案是先将氧气和空气按不同的体积比收集在集气瓶里.收集气体的装置如右图.
收集气体的方法是:在150mL集气瓶里装满水,塞紧胶塞并关闭活塞b,打开活塞a通入氧气,把瓶里的水排入量筒,当量筒内的水达到设定的体积后立即关闭活塞a,然后打开活塞b通入空气,把瓶里的水全部排入量筒.
若要收集一瓶含氧气的体积分数约为60%的气体,则停止通入氧气时量筒内水的体积约为______(选填序号).
A.75 mLB.60 mLC.40 mLD.25 mL.
 查看习题详情和答案>>
查看习题详情和答案>>
某校化学兴趣小组的同学按照课本装置(如图1)做“测定空气里氧气的含量”实验.他们将燃烧匙内的红磷点燃后,立即伸入广口瓶中并把塞子塞紧,待红磷熄灭和冷却后,打开弹簧夹,观察集气瓶中水面变化,发现气体减少的体积小于1/5.这是什么原因呢?兴趣小组的四位同学就该现象做了如下探究.请你参与他们的探究,并回答有关问题:
【提出问题】
造成这个结果的原因是什么?如何改进?
【猜想和假设】
排除了属于偶然现象的原因之后,其中三位同学对原因做了如图2的猜想:
对于这一现象的原因,你还能做出怎样的猜想?请写出你的一个合理猜想:______.
【分析与交流】
对小周的猜想,大家一致认为小周的猜想不合理,并认为这样做的结果将使误差更大,原因是:______.
【实验与结论】
(1)小吴决定使用原装置重做实验,并在实验前重新检验了装置的气密性.小吴检验气密性的正确方法是:______.
(2)为了验证小施的猜想,同学们将500mL的残余气体与足量灼热的铜粉充分反应,结果发现铜粉增重0.028g.(为避免残余气体中CO2及水蒸气可能造成的干扰,在实验前已将它们除去)
由上述实验事实可知,残余气体中______氧气(填“有”或“没有”,如果选“没有”,后一个空填“0”);残余气体中氧气的体积占______%(已知该条件下氧气的密度为1.4g/L).
【反思与评价】
针对课本实验装置和操作的不足,小沈同学经过认真思考,改进并设计了如图3实验装置,与原来的装置相比较,请你说出新装置的两个优点:(1)______;(2)______.
查看习题详情和答案>>
某校化学兴趣小组的同学按照课本装置(如图1)做“测定空气里氧气的含量”实验.他们将燃烧匙内的红磷点燃后,立即伸入广口瓶中并把塞子塞紧,待红磷熄灭和冷却后,打开弹簧夹,观察集气瓶中水面变化,发现气体减少的体积小于1/5.这是什么原因呢?兴趣小组的四位同学就该现象做了如下探究.请你参与他们的探究,并回答有关问题:
【提出问题】
造成这个结果的原因是什么?如何改进?
【猜想和假设】
排除了属于偶然现象的原因之后,其中三位同学对原因做了如图2的猜想:
对于这一现象的原因,你还能做出怎样的猜想?请写出你的一个合理猜想: .
【分析与交流】
对小周的猜想,大家一致认为小周的猜想不合理,并认为这样做的结果将使误差更大,原因是: .
【实验与结论】
(1)小吴决定使用原装置重做实验,并在实验前重新检验了装置的气密性.小吴检验气密性的正确方法是: .
(2)为了验证小施的猜想,同学们将500mL的残余气体与足量灼热的铜粉充分反应,结果发现铜粉增重0.028g.(为避免残余气体中CO2及水蒸气可能造成的干扰,在实验前已将它们除去)
由上述实验事实可知,残余气体中 氧气(填“有”或“没有”,如果选“没有”,后一个空填“0”);残余气体中氧气的体积占 %(已知该条件下氧气的密度为1.4g/L).
【反思与评价】
针对课本实验装置和操作的不足,小沈同学经过认真思考,改进并设计了如图3实验装置,与原来的装置相比较,请你说出新装置的两个优点:(1) ;(2) . 查看习题详情和答案>>

【提出问题】
造成这个结果的原因是什么?如何改进?
【猜想和假设】
排除了属于偶然现象的原因之后,其中三位同学对原因做了如图2的猜想:
对于这一现象的原因,你还能做出怎样的猜想?请写出你的一个合理猜想: .
【分析与交流】
对小周的猜想,大家一致认为小周的猜想不合理,并认为这样做的结果将使误差更大,原因是: .
【实验与结论】
(1)小吴决定使用原装置重做实验,并在实验前重新检验了装置的气密性.小吴检验气密性的正确方法是: .
(2)为了验证小施的猜想,同学们将500mL的残余气体与足量灼热的铜粉充分反应,结果发现铜粉增重0.028g.(为避免残余气体中CO2及水蒸气可能造成的干扰,在实验前已将它们除去)
由上述实验事实可知,残余气体中 氧气(填“有”或“没有”,如果选“没有”,后一个空填“0”);残余气体中氧气的体积占 %(已知该条件下氧气的密度为1.4g/L).
【反思与评价】
针对课本实验装置和操作的不足,小沈同学经过认真思考,改进并设计了如图3实验装置,与原来的装置相比较,请你说出新装置的两个优点:(1) ;(2) . 查看习题详情和答案>>