网址:http://m.1010jiajiao.com/timu3_id_116508[举报]

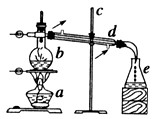
a____________;b____________;c____________;d____________;e ____________。
(2)得到的蒸馏水在_____________中。
(3)仔细观察d仪器,它起到__________________________作用;冷水进入d仪器的方向如图所示,如果改为从上端流入,下端流出行不行?_____________(选填“行”或“不行”),其原因是__________________________。
(4)水在_____________中由液态变为气态,在_____________中由气态变为液态。
(14分)实验室获取氮气有很多种途径,常见的有3种方法。
方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。
为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。
方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。
【查阅资料】
(1)NaNO2+NH4Cl NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
① ;
②20℃时,取含溶质0.21g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是 ;
(2)步骤④中,移走酒精灯的目的是 ;
(3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数)
【解释与结论】
1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
C
防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气
C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的
方法一:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末,测得该气体的密度为1.2572g/L。 进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置)。
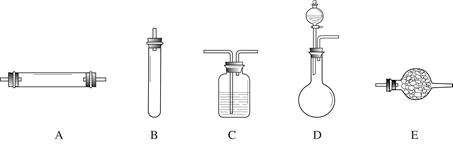
为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置 (选填装置编号)中加入 (填名称)以除去其它杂质气体。
方法三:将亚硝酸钠(NaNO2)和氯化铵的饱和溶液加热,氮元素全部转化为氮气。下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题。
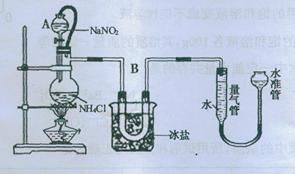
【查阅资料】
(1)NaNO2+NH4Cl
 NaCl+N2↑+2H2O
NaCl+N2↑+2H2O(此反应会放出大量的热);
(2)B部分中冰盐是冷凝作用
【实验探究】
① ;
②20℃时,取含溶质0.21g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12.0mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】
(1)加入药品前必须进行的实验①是 ;
(2)步骤④中,移走酒精灯的目的是 ;
(3)计算生成氮气的质量和密度。 (4分,计算过程中以及最终数据均保留2位小数)
【解释与结论】
1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大5‰左右。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是 (已知:相同条件下,气体的相对分子质量越大,密度就越大)
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是
C
防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气
C.使NaNO2饱和溶液顺利滴下 D.防止溶液冲入U形管
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习 和生活中要学习科学家的 .
A.严谨求实的科学态度和敢于怀疑的批判精神
B.科学研究中遇到疑惑就趁早放弃,不要浪费时间
C.不能因为微小的差异而放过一次成功的机会
D.要相信权威,权威一定是正确的

(1)写出下列仪器名称:a ;b 。
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是 (填装置的字母代号),化学方程式是 ,用双氧水制取氧气的化学方程式为 。
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是 ,若将E装置中收集的氢气排出,应从 (填c或d)口通入蒸馏水。
(4)装置C相对于装置B在操作方面的优势为 。
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一] 探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| | 甲 | 乙 |
| 实验过程 | 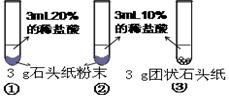 |  |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③。 |  |
| 分析结论 | Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越。 Ⅳ 乙同学的实验中,数据记录纸上应该连续记录的实验数据是 和 。 | |
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和。)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。下图(Ⅰ)为石头纸与稀盐酸反应的装置,图(Ⅱ)用于测量CO2的体积。

① 连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置(I)气密性 (选填“良好”或“漏气”)
② 图(Ⅱ)装置中油层的作用是_ ;
③ 反应停止后, (填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
A. 水平移动量气管 B.上下移动量气管 C. 封闭量气管
(7) 乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
| | 第一份 | 第二份 | 第三份 | 第四份 |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
① 在第1份样品的实验中, 完全反应了。
② m为
③ 石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程,4分)
④ 请在坐标图中画出在6.25 g样品中加入稀盐酸的体积与产生气体质量的关系图。