摘要:某同学在实验室中用24.5g的氯酸钾制取氧气时发现没有二氧化锰.并向其中加入了一定质量的高锰酸钾.经充分加热后固体共减少了10.24g,试计算: (1)加入高锰酸钾的质量 (2)最终所得固体中二氧化锰的质量分数
网址:http://m.1010jiajiao.com/timu3_id_116002[举报]
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
(1)通过实验①和②对比可知,化学反应速率与
(2)从实验
(3)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的碰撞率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
(4)某同学在实验室中用老师提供的过氧化氢溶液和二氧化锰的混合物为原料制取氧气,一段时间后,产生氧气0.16g.试计算①至少需要过氧化氢的物质的量?(根据化学方程式列式计算)
②生成水
查看习题详情和答案>>
| 实验 序号 |
H2O2溶液 浓度% |
H2O2溶液 体积/mL |
温度℃ | MnO2的 质量/g |
收集氧气的 体积/mL |
反应所需的 时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
反应物浓度
反应物浓度
有关;(2)从实验
③和④
③和④
对比可知,化学反应速率和温度的关系是温度越高,化学反应速率越快
温度越高,化学反应速率越快
.(3)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的碰撞率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
反应物浓度越大,反应物分子的间隙越小,碰撞率越大,化学反应速率越快
反应物浓度越大,反应物分子的间隙越小,碰撞率越大,化学反应速率越快
.(4)某同学在实验室中用老师提供的过氧化氢溶液和二氧化锰的混合物为原料制取氧气,一段时间后,产生氧气0.16g.试计算①至少需要过氧化氢的物质的量?(根据化学方程式列式计算)
②生成水
0.18
0.18
克.某同学在实验室中用氯酸钾和二氧化锰制取氧气,并回收二氧化锰.下表为该同学实验的有关数据:
求:
(1)该同学总共收集到多少克氧气?
(2)最多能回收到多少克二氧化锰?
查看习题详情和答案>>
| 实验前, 试管内固体的质量 |
充分加热后试管内 固体剩余物的质量 |
| 19.4g | 14.6g |
(1)该同学总共收集到多少克氧气?
(2)最多能回收到多少克二氧化锰?
某同学在实验室中用加热高锰酸钾制取氧气后,发现试管炸裂了,请你分析一下可能是什么原因造成的?(至少答出两条)
查看习题详情和答案>>
试管口没有略向下倾斜
试管口没有略向下倾斜
;收集完氧气后先熄灭酒精灯后将导管从水中拿出来
收集完氧气后先熄灭酒精灯后将导管从水中拿出来
.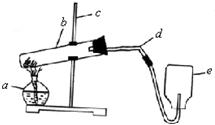 15、某同学在实验室中用高锰酸钾制氧气,设计安装了如下装置,请回答以下问题:
15、某同学在实验室中用高锰酸钾制氧气,设计安装了如下装置,请回答以下问题:(1)请识别有标号仪器的名称
a
酒精灯
b
试管
c
铁架台
d
导管
e
集气瓶
(2)请分析找出装置中的错误并加以改正.
大试管口向上倾斜,大试管口略向下倾斜
没有放棉花,试管口放一块棉花
用向下排空气法收集,应用排水集气法收集
没有放棉花,试管口放一块棉花
用向下排空气法收集,应用排水集气法收集
(3)改正装置后,收集好的氧气移出水面应
正
放桌上.(4)收集氧气除了可以用排水法之外,还可以用
向上排空气
法收集,理由是
氧气的密度比空气略大
.(5)实验结束时,应先把
导管从水槽中拿出
,再
再熄灭酒精灯
.(6)用什么简单方法检验这瓶无色气体是氧气
用一根带火星的木条伸入集气瓶中,木条复燃证明是氧气
.