网址:http://m.1010jiajiao.com/timu3_id_115902[举报]
(9分)碳及其化合物在生活中应用广泛。
⑴ 下列用途中,主要利用了物质的物理性质的有 。(填序号)
①将小块金刚石镶在玻璃刀头上用来裁玻璃; ② 将石墨用于制作电极;
③一氧化碳用作气体燃料; ④干冰用于人工降雨; ⑤一氧化碳可用于炼铁。
⑵ 干冰的物质类型不属于 。(填序号)
| A.混合物 | B.纯净物 | C.化合物 | D.氧化物 |
⑷ 一氧化碳燃烧时火焰呈蓝色,该反应的化学方程式为 。
⑸ 在汽车尾气系统中装置催化转化器,可将一氧化碳和一氧化氮有毒气体转化为无毒的二氧化碳和氮气,该反应的化学方程式为 。
⑹ 某生态农业对农家肥料进行综合利用,经发酵得到一种含甲烷的混合气体。该气体中的甲烷(CH4)可用来还原氧化铜,反应的化学方程式为:
CH4+4CuO
 CO2+2
CO2+2 +4Cu
+4Cu① 上述 “
 ”内对应产物的化学式为 ;
”内对应产物的化学式为 ;② 实验过程中可观察到,氧化铜变为 色;
③ 该反应中,铜元素的化合价是否发生改变 (填“是”或“否”);
④ 用足量的CO和CH4分别还原两份等质量的氧化铜,则两个反应生成铜的质量比为 查看习题详情和答案>>
(9分)碳及其化合物在生活中应用广泛。
⑴ 下列用途中,主要利用了物质的物理性质的有 。(填序号)
①将小块金刚石镶在玻璃刀头上用来裁玻璃; ② 将石墨用于制作电极;
③一氧化碳用作气体燃料; ④干冰用于人工降雨; ⑤一氧化碳可用于炼铁。
⑵ 干冰的物质类型不属于 。(填序号)
A.混合物 B.纯净物 C.化合物 D.氧化物
⑶ 一氧化碳与赤铁矿(主要成分Fe2O3)炼铁反应的化学方程式为 。
⑷ 一氧化碳燃烧时火焰呈蓝色,该反应的化学方程式为 。
⑸ 在汽车尾气系统中装置催化转化器,可将一氧化碳和一氧化氮有毒气体转化为无毒的二氧化碳和氮气,该反应的化学方程式为 。
⑹ 某生态农业对农家肥料进行综合利用,经发酵得到一种含甲烷的混合气体。该气体中的甲烷(CH4)可用来还原氧化铜,反应的化学方程式为:
CH4+4CuO CO2+2
CO2+2 +4Cu
+4Cu
① 上述 “ ”内对应产物的化学式为 ;
”内对应产物的化学式为 ;
② 实验过程中可观察到,氧化铜变为 色;
③ 该反应中,铜元素的化合价是否发生改变 (填“是”或“否”);
④ 用足量的CO和CH4分别还原两份等质量的氧化铜,则两个反应生成铜的质量比为
查看习题详情和答案>>
⑴ 下列用途中,主要利用了物质的物理性质的有 。(填序号)
①将小块金刚石镶在玻璃刀头上用来裁玻璃; ② 将石墨用于制作电极;
③一氧化碳用作气体燃料; ④干冰用于人工降雨; ⑤一氧化碳可用于炼铁。
⑵ 干冰的物质类型不属于 。(填序号)
| A.混合物 | B.纯净物 | C.化合物 | D.氧化物 |
⑷ 一氧化碳燃烧时火焰呈蓝色,该反应的化学方程式为 。
⑸ 在汽车尾气系统中装置催化转化器,可将一氧化碳和一氧化氮有毒气体转化为无毒的二氧化碳和氮气,该反应的化学方程式为 。
⑹ 某生态农业对农家肥料进行综合利用,经发酵得到一种含甲烷的混合气体。该气体中的甲烷(CH4)可用来还原氧化铜,反应的化学方程式为:
CH4+4CuO
 CO2+2
CO2+2 +4Cu
+4Cu① 上述 “
 ”内对应产物的化学式为 ;
”内对应产物的化学式为 ;② 实验过程中可观察到,氧化铜变为 色;
③ 该反应中,铜元素的化合价是否发生改变 (填“是”或“否”);
④ 用足量的CO和CH4分别还原两份等质量的氧化铜,则两个反应生成铜的质量比为
(1)空气成分按体积计算,含量最多的是____(填写化学式)。
(2)工业上用分离液态空气的方法制备氧气,这一过程属于____(填“物理”或“化学”)变化;实验室可通过多种途径制取氧气,如分解过氧化氢、加热高锰酸钾、电解水等,从降低能量消耗上考虑,你选择的实验室制取氧气的方法是____。
(3)下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并作上记号。下列说法中正确的是____(填字母序号)。
A.燃烧匙中的红磷可以换成硫或木炭
B.最终进入瓶中水的体积约为氧气的体积
C.燃烧匙中的红磷越多,瓶中的水位上升得越高
D.本实验可以证明空气中含有N2、O2、CO2和稀有气体


②酸雨的形成主要是二氧化硫与水作用产生的亚硫酸(H2SO3)被空气中的氧气氧化为硫酸的缘故。该氧化反应的化学方程式为_________________________。
(5)保护空气,提倡“低碳”,减缓温室效应,是我们必须关注的问题。科学家正在研究如下图所示的新的二氧化碳循环体系。

A.二氧化碳也是一种重要的资源
B.利用降温、加压将二氧化碳分离是化学变化
C.二氧化碳与氢气在复合催化剂下反应,其产物是混合物
D.液化石油气、汽油、甲醇等物质燃烧都有二氧化碳产生
I: 牙膏是人们生活中的必需品,在牙膏的生产中常添加一种摩擦剂。这种摩擦剂是由某种自然界中分布很广的矿石A,经过一系列加工而制得的极细小的轻质碳酸钙粉末,其生产过程如下:
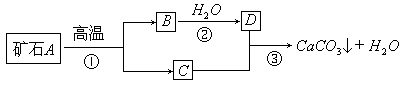
试回答:
(1)写出 C、D两种物质的化学式 C_____D_____
(2)写出③反应的化学方程式_______________________
(3)反应③制轻质碳酸钙粉末后,还要通过 (填操作)将其从反应后的混合物中分离出来。实验室进行该操作时主要用到的玻璃仪器有:烧杯、玻璃棒、
II、某兴趣小组为了测定本地所产矿石A的纯度,利用下图装置设计了以下实验方案:
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数。
【实验步骤】
①连接装置并检查装置气密性;
②在试管B中加入10克矿石A,分液漏斗中加入足量的稀盐酸,C、D管中加入一定量的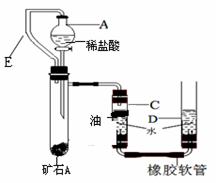 水,C管的液面上加一 层油,并将分液漏斗A和试管B用长导管E连接起来。
水,C管的液面上加一 层油,并将分液漏斗A和试管B用长导管E连接起来。
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中
|
![]() 体密度为ρg/L);
体密度为ρg/L);
⑥计算气体的质量并由此求出矿石A中碳酸钙的质量分数
【实验分析】
(1)小明同学认为在实验前要将矿石A 全磨成粉末状,你认为他的目的是:
;
(2)小洁同学认为该实验的设计中最经典的是连接仪器A和仪器B的橡胶管E,你认为如果没有橡胶管E,则会对实验结果产生何种影响?
(3)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(4)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验:清判断并说明理由 。
(5)实验结束时同学们才发现由于粗心,小伟将植物油加到了D管的水面上,大家一致认为由于该粗心将会导致测得的矿石A中碳酸钙的质量分数产生误差,你认为该误差是 (填偏大或偏小) 。
(6)化学老师看了他们的实验设计后,对他们的设计方案和合作意识、探究精神都给予了很高的评价,并对他们进行启发:二氧化碳的质量可以根据质量守恒定律,测反应前后烧杯中剩余物质的质量之差来求得,于是他们又在烧杯中进行了如下的实验测定:
| 实验次数 项目 | 第一次 | 第二次 | 第三次 |
| 所取矿石A的质量/g | 12 | 12 | 15 |
| 所加稀盐酸的质量/g | 120 | 150 | 100 |
| 剩余物质的质量 | 127.6 | 157.6 | 110.6 |
请你和他们一起完成实验数记的分析和计算:
①当所取矿石A和稀盐酸的质量比 时,矿石A和稀盐酸恰好完全反应。
②矿石A中碳酸钙的质量分数是多少?(2分)
③所用稀盐酸的溶质质量分数是多少?(2分)
查看习题详情和答案>>