摘要:6.要使二胡发出的音调更高.可采用的方法是 ( ) A.把二胡弦线拧紧些 B.把二胡弦线拧松些 C.增加发声部分弦的长度 D.用一根较粗的弦代替原来的弦
网址:http://m.1010jiajiao.com/timu3_id_114217[举报]
 如图所示,将CO2、CO的混和气体作如下实验,根据图示信息,回答下列问题.
如图所示,将CO2、CO的混和气体作如下实验,根据图示信息,回答下列问题.(1)写出图示编号仪器的名称.
A
导管
导管
B铁架台
铁架台
C广口瓶
广口瓶
.(2)当混合气体通过右图装置时:甲中产生的现象是(石灰水足量)
石灰水变浑浊
石灰水变浑浊
,反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.甲瓶的作用是除去原气体中的二氧化碳
二氧化碳
,乙处观察到的现象是黑色的氧化铜变成红色
黑色的氧化铜变成红色
,化学方程式为CuO+CO
Cu+CO2
| ||
CuO+CO
Cu+CO2
,丙处观察到的现象是
| ||
石灰水变浑浊
石灰水变浑浊
.丁处燃烧的火焰颜色是蓝色
蓝色
,化学方程式为CO+O2
CO2
| ||
CO+O2
CO2
.点燃的目的是
| ||
一氧化碳有毒,防止空气污染
一氧化碳有毒,防止空气污染
.(3)上述装置应作怎样的改进,才能充分体现节约这一科学原则,使混合气体的利用率更高?
把丁的尖嘴对着乙中的氧化铜的正下方燃烧
把丁的尖嘴对着乙中的氧化铜的正下方燃烧
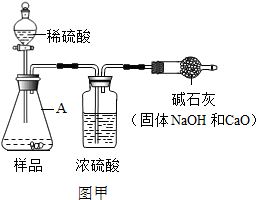
.(2013?金华)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.

【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度.
【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略).装置中,仪器A的名称
【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差.你认为下列哪些因素会导致难以避免的误差
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
【方案改进】为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略).图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是
【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成
查看习题详情和答案>>

【原理思路】利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度.
【实验方案】小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略).装置中,仪器A的名称
锥形瓶
锥形瓶
.【交流讨论】小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差.你认为下列哪些因素会导致难以避免的误差
②③④
②③④
(填序号).①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
【方案改进】为减少误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略).图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是
关闭c、打开a、b
关闭c、打开a、b
.【数据分析】若撤去图乙中的C装置,则测得工业烧碱的纯度将
偏低
偏低
(填“偏高”、“偏低”或“无影响”).【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成
Na2SO4和H2SO4;Na2SO4;Na2SO4和NaHCO3
Na2SO4和H2SO4;Na2SO4;Na2SO4和NaHCO3
.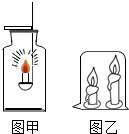 (2013?淄川区模拟)小明同学对蜡烛的燃烧情况进行了如下探究.请你帮他完成下列问题:
(2013?淄川区模拟)小明同学对蜡烛的燃烧情况进行了如下探究.请你帮他完成下列问题:(1)在空气中点燃蜡烛,观察,发现火焰上方有黑烟,然后放入一瓶干燥的氧气中,发现蜡烛在氧气中比在空气中燃烧更旺,发出白光(如图甲所示).你认为蜡烛燃烧更旺的原因是
集气瓶中氧气的浓度大
集气瓶中氧气的浓度大
.由此联想到要使燃料燃烧释放出更多热量,并减少对空气的污染,应该设法使燃料与充足的氧气接触
与充足的氧气接触
.(2)上述实验中,刚开始看到集气瓶壁上出现一层水膜,过一会儿,发现瓶壁又变得透明.从分子的角度考虑,是因为水分子
获得
获得
能量,分子运动加快
加快
,致使瓶壁上的液态水逐渐蒸发:然后向集气瓶中倒入少量澄清石灰水,晃动,发现澄清石灰水变浑浊.由以上现象得出结论:蜡烛的成分中至少含有碳
碳
元素(填元素名称);(3)小明又做了如图乙所示的实验.你会发现先熄灭的是
长
长
蜡烛.由此联想到:火灾现场,浓烟以及有毒气体是在上部空间,应匍匐或爬行逃离现场.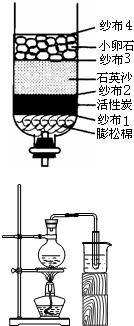 26、右图所示简易净水器.取来一杯比较浑浊的河水,经过该净水器后,从导管口流出的水明显澄清了.
26、右图所示简易净水器.取来一杯比较浑浊的河水,经过该净水器后,从导管口流出的水明显澄清了.(1)根据上述净化材料的特性,活性炭的作用是
吸附水中的色素和异味
;(2)该净水器不同位置的纱布所起的主要作用不同,其中第二层纱布的作用是:
使石英沙和活性炭分开
(3)用试管取少量下部导管流出的水,再加入肥皂水振荡,发现试管内有较多的浮渣产生.你认为上述简易净水器流出的水是
硬水
(填“硬水”或“软水”.)(4)要想进一步净化得到纯度更高的蒸馏水,常用如右图所示的装置.①在连接好装置后,应先进行
检验装置气密性
的操作,再加入水和沸石进行蒸馏;②在烧瓶中加入沸石的目的是防止液体暴沸
.③烧杯中水的作用是
冷凝剂
. (2013?丽水)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.
(2013?丽水)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.利用Na2CO3与稀H2SO4反应产生CO2,通过CO2质量的测定,确定样品中碳酸钠的质量,从而计算样品纯度.
(1)小科同学根据以上思路,设计了如图甲的实验方案(固定装置省略),图中仪器A的名称是
锥形瓶
锥形瓶
.(2)小明认为图甲实验方案的设计有缺陷,若按该方案进行测定会导致难以避免的误差,如装置内空气中的CO2没有排出、反应产生的CO2未被完全吸收等.为减小误差,使CO2质量的测定更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略)
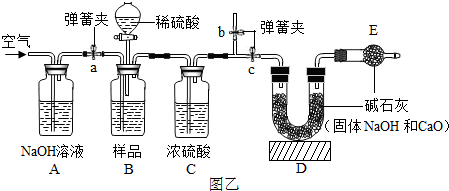 图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是打开弹簧夹a和b,关闭弹簧夹c
打开弹簧夹a和b,关闭弹簧夹c
.(3)若撤去图乙中的C装置,则测得工业烧碱的纯度将
偏低
偏低
(填“偏高”、“偏低”或“无影响”).(4)已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.
现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成
硫酸钠;硫酸钠和硫酸;硫酸钠和碳酸氢钠
硫酸钠;硫酸钠和硫酸;硫酸钠和碳酸氢钠
.