网址:http://m.1010jiajiao.com/timu3_id_112627[举报]
【查阅资料】
1、草酸亚铁晶体热分解的气体产物是H2O,CO,CO2
2、白色的无水CuSO4遇水蒸气会变成蓝色
【实验设计】
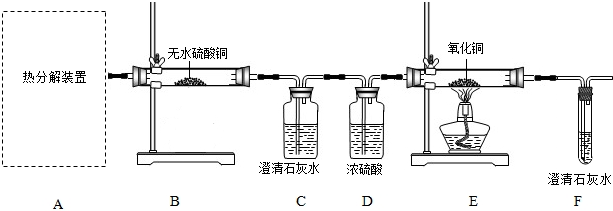
(1)从环保角度考虑,该套实验装置的明显缺陷是
(2)可选择以下实验装置中的
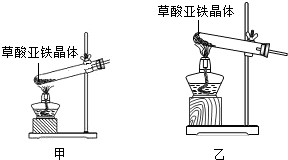
【问题讨论】
(3)D中浓硫酸的作用是
(4)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是
(5)若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产物中有CO,则需在C和D装置之间增加盛有
【数据分析】
(6)称取3.60g草酸亚铁晶体(FeC2O4?2H2O,相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示,请分析该图回答下列问题:
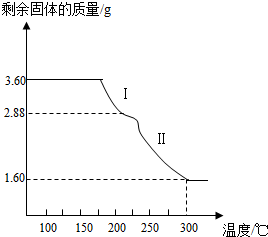
①过程Ⅰ发生反应的化学方程式为
| ||
| ||
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式或名称
| 钠是一种非常活拨的金属,遇空气中的氧或水等物质均会发生化学反应。工业上给密封状态下电解池中的熔融的NaCl通入直流电,NaCl发生分解得到金属钠和氯气。请完成下列各题: (1)下列二种物质是由什么粒子构成的:钠___________,氯气__________; (2)下列微粒结构示意图各表示的是什么微粒,写出其化学符号: A_________; B_____________; |
 |
| (3)写出工业上电解制钠的化学方程式____________;该过程中钠元素的化合价是怎样变化的?__________; (4)NaCl是由钠离子和氯离了构成的离子化合物。从微观角度分析电解过程中发生的化学变化,并正确推断:钠离子__________变成钠原子,氯原子____________变成氯原子,所以,在电解池中正极(+)上得到的是 _________,负极(-)上得到的是___________。 (5)金属钠敞放在空气中会发生氧化,生成一种名叫过氧化钠的固体。过氧化钠与过氧化氢有类似结构。写出钠氧化的化学方程式__________ 。该反应的基本类型为__________反应。 (6)过氧化钠有如下特性:2Na2O2 + 2CO2 ==2Na2CO3 + O2↑,故过氧化钠可用于潜艇潜航时的制氧剂。该反应是否属于基本类型反应?____________。 |
(1)下列二种物质是由什么粒子构成的:

钠
氯气
(2)微粒结构示意图如图各表示的是什么微粒,写出其化学符号:
A
B
(3)写出工业上电解制钠的化学方程式
| ||
| ||
(4)NaCl是由钠离子和氯离了构成的离子化合物.从微观角度分析电解过程中发生的化学变化,并正确推断:钠离子
(5)金属钠敞放在空气中会发生氧化,生成一种名叫过氧化钠的固体.过氧化钠与过氧化氢有类似结构.写出钠氧化的化学方程式
(6)过氧化钠有如下特性:2Na2O2+2CO2═2Na2CO3+O2↑,故过氧化钠可用于潜艇潜航时的制氧剂.该反应是否属于基本类型反应?
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:
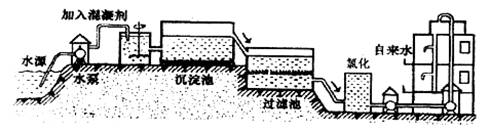
上图过滤池中有活性炭层,该过程中发生 变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制![]() 溶液时不宜使用自来水,其原因是(用化学方程式表示) 。高锰酸钾(
溶液时不宜使用自来水,其原因是(用化学方程式表示) 。高锰酸钾(![]() )是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 。
)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是 。
(2)电解水时,加入少量![]() 可以增强水的导电性。现将0.1g
可以增强水的导电性。现将0.1g![]() 溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中
溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是 ,当溶液中![]() 的质量分数变为0.2%时,有 水被分解。
的质量分数变为0.2%时,有 水被分解。
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有![]() 、
、![]() 、
、![]() 、
、![]() 中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是 。
②乙处河水呈红褐色的化学方程式是 。
③丁处产生气泡的化学方程式是 。
查看习题详情和答案>>水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
自来水的生产过程大体如下图

(1)上图过滤池中有活性炭层,活性炭起____作用,该过程中发生________变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制![]() 溶液时不宜使用自来水。其原因是(用化学方程式表示)_____________________。高铁酸钾(
溶液时不宜使用自来水。其原因是(用化学方程式表示)_____________________。高铁酸钾(![]() )是一种理想的水处理剂,高铁酸钾中铁元素的化合价是__________。
)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是__________。
(2)电解水时,加入少量![]() 可以增强水的导电性。现将O.1
可以增强水的导电性。现将O.1![]()
![]() 溶解在99.9
溶解在99.9 ![]() 水里。接通直流电源后,与电源正极相连的一端放出的气体是________,当溶液中
水里。接通直流电源后,与电源正极相连的一端放出的气体是________,当溶液中![]() 的质量分数变为0.2%时,有_______水被分解。
的质量分数变为0.2%时,有_______水被分解。
(3)在河旁有甲、乙、丙、丁四座工厂(位置如下图所示),每个工厂排出的废液含有![]() 、
、![]() 、
、![]() 、
、![]() 中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:

①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是_____。
②乙处河水呈红褐色的化学方程式是______________
③丁处产生气泡的化学方程式是______________
④保护水资源,我们应该采取的措施是_______________。
查看习题详情和答案>>