网址:http://m.1010jiajiao.com/timu3_id_112507[举报]
(1)pH试纸测定溶液的酸碱度时,用
(2)某无色溶液滴入紫色石蕊试液变红色.若用pH试纸测定该溶液的pH可能是
A.0 B.2.5 C.3 D.11
(3)某实验小组对一硫酸厂附近地区的雨水进行取样并测定其pH,数据记录如下:
| 测定时间 | 5:05 | 5:10 | 5:15 | 5:20 | 5:25 | 5:30 | 5:35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
?若该硫酸厂排放的尾气中含有较多的SO2、CO2等,分析造成该地区酸雨的主要原因是
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.

表1 生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元.╱吨) |
| 漂液 | 含NaClO 25.2% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98.5% | 2100 |
| 纯碱 | 含Na2CO399.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式
(2)在步骤②中加入的物质X,最佳的选择应是
(3)在步骤③中加入的物质Y应是
(4)在步骤④中加入的物质Z应是
(5)在步骤⑤时发生的化学反应方程式是
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.

表1 生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元.╱吨) |
| 漂液 | 含NaClO 25.2% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98.5% | 2100 |
| 纯碱 | 含Na2CO399.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式______;
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式______.
(2)在步骤②中加入的物质X,最佳的选择应是______,理由是______.
(3)在步骤③中加入的物质Y应是______,之所以要控制pH=9.8,其目的是______.
(4)在步骤④中加入的物质Z应是______.
(5)在步骤⑤时发生的化学反应方程式是______.
先阅读下列短文,再回答下列问题:
在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+。Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2。“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质。若以它为原料,按下图工艺流程即可制得“轻质氧化镁”。若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定。
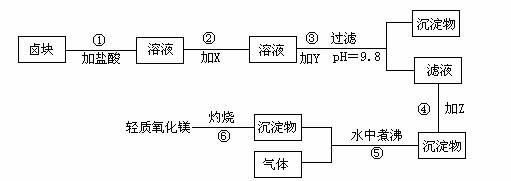
表1: 表2:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)3 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元/吨) |
| 漂液 | 含NaClO 25.5% | 450 |
| 过氧化氢 | 含H2O2 30% | 240 |
| 烧碱 | 含NaOH 98% | 2100 |
| 纯碱 | 含Na2CO3 99.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
请填下列空白:
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:
,写出在盐酸溶液中H2O2将FeCl2氧化成FeCl3,同时生成H2O的化学方程式: 。
(2)在步骤2中加入物质X,最佳的选择应是 ,理由是
。
(3)在步骤3中加入的物质应是 ,之所以要控制pH=9.8,其目的是
。
(4)在步骤4中加入物质应是 。
(5)在步骤5中发生的化学方程式为 。
查看习题详情和答案>>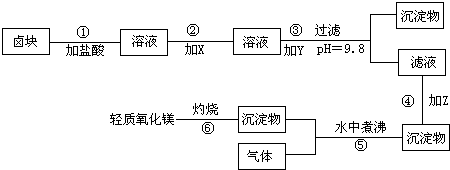
在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按如图工艺流程即可制得“轻质氧化镁”.若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定.
表1:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)3 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元/吨) |
| 漂液 | 含NaClO 25.5% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98% | 2100 |
| 纯碱 | 含Na2CO3 99.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:______,写出在盐酸溶液中H2O2将FeCl2氧化成FeCl3,同时生成H2O的化学方程式:______.
(2)在步骤2中加入物质X,最佳的选择应是______,理由是______.
(3)在步骤3中加入的物质应是______,之所以要控制pH=9.8,其目的是______.
(4)在步骤4中加入物质应是______.
(5)在步骤5中发生的化学方程式为______.