摘要:11.将0.1mol/L稀氨水加水稀释.下列说法正确的是 A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大 C.NH3·H2O电离平衡向左移动 D.溶液pH增大
网址:http://m.1010jiajiao.com/timu3_id_112504[举报]
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是
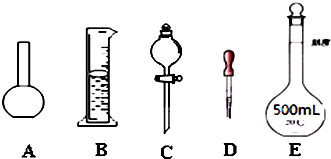
(2)下列操作中,容量瓶所不具备的功能有
A、配制一定体积准确浓度的标准溶液
B、贮存溶液
C、测量容量瓶规格以下的任意体积的液体
D、准确稀释某一浓度的溶液
E、用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
查看习题详情和答案>>
(1)如图所示的仪器中配制溶液肯定不需要的是
ABC
ABC
(填序号),配制上述溶液还需用到的玻璃仪器是玻璃棒、烧杯
玻璃棒、烧杯
(填仪器名称).
(2)下列操作中,容量瓶所不具备的功能有
BCE
BCE
(填序号).A、配制一定体积准确浓度的标准溶液
B、贮存溶液
C、测量容量瓶规格以下的任意体积的液体
D、准确稀释某一浓度的溶液
E、用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
2.0
2.0
g.在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度小于
小于
0.1mol/L(填“大于”、“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度小于
小于
0.1mol/L.(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
13.6
13.6
mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用15
15
mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌
.配制0.1mol/L盐酸溶液500mL,请按操作顺序[(1)、(2)、(3)…]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字.
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500mL),用玻璃棒搅拌,使其混匀.
( )待稀释的盐酸冷却后,沿玻璃棒注入500mL的容量瓶中.
( )用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约 mL注入烧杯中.
( )用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中.
( )往容量瓶中小心加蒸馏水至液面接近刻度 cm处,改用 加蒸馏水,使溶液 恰好与刻度线相切.
查看习题详情和答案>>
(
(
(
(
(
将a g含NaOH样品溶解在 b mL 0.1 mol?L-1 硫酸中,再加入c mL 0.1mol?L-1的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中 NaOH 的纯度是( )
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4 - 氧化Fe2+的离子方程式补充完整:
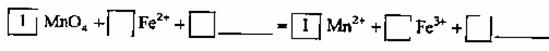
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的: 。
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
② Ⅳ 中加入MnSO4的目的是 。
查看习题详情和答案>>