摘要:10.一定温度下2SO2 + O2 2SO3.达到平衡时.n(SO2)︰n(O2) ︰n(SO3)=3︰2︰4.缩小体积.反应再次达到平衡时.n(O2)=0.4mol.n(SO3)=1.6mol.此时SO2的物质的量应是 A.0.5mol B.0.6moL C.0.7mol D.1.2mol
网址:http://m.1010jiajiao.com/timu3_id_112503[举报]
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.(1)某温度下,SO2(g)+
| 1 | 2 |
50%
50%
.(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都 比原来增大的是
A、C、F
A、C、F
(填字母).A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以如图所示装置用电化学原理生产硫酸,
写出通入SO2的电极的电极反应式:
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
.检验其中产物有SO42-的具体操作为
取少量溶液于试管中加入盐酸,无明显现象,再加入BaCl2溶液,若产生白色沉淀说明溶液中含SO42-
取少量溶液于试管中加入盐酸,无明显现象,再加入BaCl2溶液,若产生白色沉淀说明溶液中含SO42-
.(4)下列关于2SO2(g)+O2(g)?2SO3(g)反应的图象中,正确的是
ABD
ABD
.
SO2中的S元素处于中间价态既具有氧化性又具有还原性,它还是酸性氧化物和具有漂白性.将SO2气体通入酸性KMnO4中,酸性KMnO4褪色,SO2表现
还原性
还原性
性,其中氧化剂和还原剂物质的量之比为2:5
2:5
(已知KMnO4酸性条件下的还原产物为Mn2+)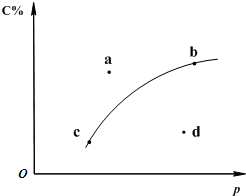 对于可逆反应2A(?)+B(g)2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:
对于可逆反应2A(?)+B(g)2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:(1)物质A的状态是
(2)图中a、b、c、d四点中表示未达到平衡状态且v正<v逆的点是
(3)在a、b、c三种条件下达平衡时,v(a)、v(b)、v(c)按由大到小排序
(4)对于2SO2(g)+O2(g)2SO3(g);△H=-198kJ/mol.在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右.
请问原料气中SO2与O2的体积比不是2:1,而要7:11(大约2:3)的原因是