摘要:一般情况下.金属越活泼.与酸反应的速度越快.为了探究金属Mg.Zn.Fe与酸反应的快慢.某研究性学习小组设计了如下的实验. [实验步骤] ①取A.B.C三支试管.分别加入2 mL溶质质量分数相等的稀盐酸, ②分别加入足量的.大小相等的Mg.Zn.Fe三种金属片.立即把三个相同的气球分别套在各试管口上. [实验预测与分析] (1)写出铁与稀盐酸反应的化学方程式: . (2)气球膨胀速度最快的是 . (3)该实验表明.实验室一般选用锌而不选用镁.铁制取氢气的主要原因是: . (4)步骤②是实验成功的关键.你认为在操作过程中小组成员之间应该: . 解析:答题时要结合金属活动性顺序来思考问题. 答案:(1)Fe+2HCl====FeCl2+H2↑ (2)A (3)锌与酸反应的速率适中.容易控制(或镁与酸反应速率太快.而铁与酸反应速率太慢) (4)分工合作.团结协作等
网址:http://m.1010jiajiao.com/timu3_id_110763[举报]
一般情况下,金属越活泼,与酸反应速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(见图).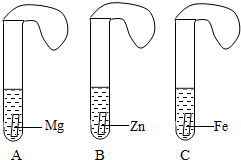
实验步骤
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;
②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
实验预测与分析
(1)写出铁与盐酸反应的化学方程式:
(2)气球膨胀速度最快的是
(3)该实验表明,实验室一般用锌而不选用镁、铁制取氢气的主要原因是:
查看习题详情和答案>>

实验步骤
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;
②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
实验预测与分析
(1)写出铁与盐酸反应的化学方程式:
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
(2)气球膨胀速度最快的是
A
A
(填试管编号).(3)该实验表明,实验室一般用锌而不选用镁、铁制取氢气的主要原因是:
锌反应速度适中,容易控制(或镁反应速度太快,而铁反应速度太慢)
锌反应速度适中,容易控制(或镁反应速度太快,而铁反应速度太慢)
. 一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验,实验步骤:
一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验,实验步骤:
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,
②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
实验现象分析:
(1)比较后发现气球膨胀速度最快的是A试管,表明Mg、Zn、Fe三种金属中Mg最活泼,写出Mg与盐酸反应的化学方程式:______.
(2)实验室一般选用Zn而不选用Mg、Fe制取氢气的主要原因是:______.
(3)为使探究达到预想目标,实验过程中需要注意的关键操作是:______.
查看习题详情和答案>>
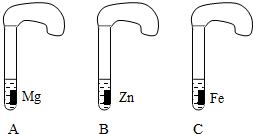 一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验.
一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验.
[实验步骤]:
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;
②分别加入足量的、大小相同的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
[实验预测与分析]
(1)写出铁与盐酸反应的化学方程式:______.
(2)气球膨胀速度最快的是______(填试管编号)
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因______.
(4)步骤②是实验获得成功的关键,你认为在操作过程中小组成员之应该______.
一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验.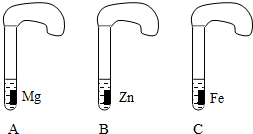
[实验步骤]
①取A、B、C三支试管,分别加入2mL溶质质量分数相等的稀盐酸;
②分别加入足量的、大小相等的Mg、Zn、Fe三种金属片,立即把三个相同的气球分别套在各试管口上.
[实验预测与分析]
(1)写出铁与稀盐酸反应的化学方程式:______.
(2)气球膨胀速度最快的是______(填试管编号).
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是:______.
(4)步骤②是实验成功的关键,你认为在操作过程中小组成员之间应该:______.
查看习题详情和答案>>
一般情况下,金属越活泼,与酸反应的速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下的实验.
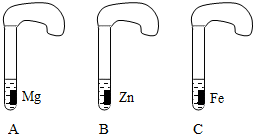
[实验步骤]
①取A、B、C三支试管,分别加入2mL溶质质量分数相等的稀盐酸;
②分别加入足量的、大小相等的Mg、Zn、Fe三种金属片,立即把三个相同的气球分别套在各试管口上.
[实验预测与分析]
(1)写出铁与稀盐酸反应的化学方程式:______.
(2)气球膨胀速度最快的是______(填试管编号).
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是:______.
(4)步骤②是实验成功的关键,你认为在操作过程中小组成员之间应该:______.
查看习题详情和答案>>

[实验步骤]
①取A、B、C三支试管,分别加入2mL溶质质量分数相等的稀盐酸;
②分别加入足量的、大小相等的Mg、Zn、Fe三种金属片,立即把三个相同的气球分别套在各试管口上.
[实验预测与分析]
(1)写出铁与稀盐酸反应的化学方程式:______.
(2)气球膨胀速度最快的是______(填试管编号).
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是:______.
(4)步骤②是实验成功的关键,你认为在操作过程中小组成员之间应该:______.