摘要:写出用石灰石作为原料制取熟石所发生反应的方程式.并注明反应的类型. (1) (2)
网址:http://m.1010jiajiao.com/timu3_id_109505[举报]
写出用石灰石作为原料制取熟石灰所发生反应的方程式,并注明反应类型.
(1)________________________________;
(2)________________________________.
写出用石灰石作为原料制取熟石灰所发生反应的方程式,并注明反应类型.
(1)________________________;
(2)________________________.
查看习题详情和答案>>
下图为实验室制取气体的装置:
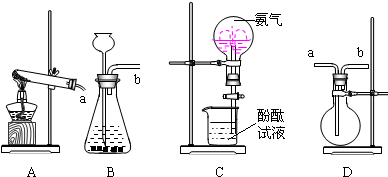
(1)用KMnO4固体制取O2,应选用上图中的 装置(填编号),
该反应的化学方程式为 ;当用排水法将O2收集满并取出集气瓶后,停止该实验的正确操作方法是 .
(2)小明同学利用上述装置进行了一些关于氨气性质的实验探究:
查询资料:氨气无色、有刺激性气味的气体,比空气轻;易液化;得液氨;极易溶于水.
探究一:将熟石灰与氯化氨混合加热可以用于制备氨气,从上图中选择装置 用于制备气体,化学反应方程式是
若采用装置D来收集氨气,气体应从 端进入.
探究二:装置C 能够形成红色的喷泉,这说明了氨气具有的性质是 、 .
(3)某化学兴趣小组定量测定炭粉和铜粉的混合物,利用下图的装置,
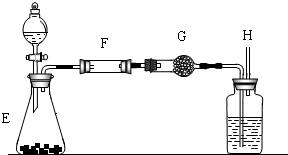
样品进行实验采用装置E来制取氧气,相对于装置B的优点是 ,请你帮助他们分析填写下表(“---”无须填写).
(4)计算:样品中铜的质量分数= (写出结果)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使F中反应完全、G中吸收完全,也不会得出正确的结果.经讨论,有同学提出在F与G之间增加一个装置.再次实验后,得到了较正确的结果.那么原来实验所测得的铜的质量分数偏小的原因可能是 ;在F与G之间增加一个装置其中盛放的药品可以是 .
查看习题详情和答案>>

(1)用KMnO4固体制取O2,应选用上图中的
该反应的化学方程式为
(2)小明同学利用上述装置进行了一些关于氨气性质的实验探究:
查询资料:氨气无色、有刺激性气味的气体,比空气轻;易液化;得液氨;极易溶于水.
探究一:将熟石灰与氯化氨混合加热可以用于制备氨气,从上图中选择装置
若采用装置D来收集氨气,气体应从
探究二:装置C 能够形成红色的喷泉,这说明了氨气具有的性质是
(3)某化学兴趣小组定量测定炭粉和铜粉的混合物,利用下图的装置,

样品进行实验采用装置E来制取氧气,相对于装置B的优点是
| 实验过程 | 实验现象 | 有关化学方程式 |
| ①连接好仪器后,检查 气密性.在F中加入样品1g,G中装入药品连装置称量为52g. | ------- | ------ |
| ②打开E处活塞,慢慢滴加溶液. | E中: | |
| ③对F进行加热.当F中药品充分反应后,关闭E处活塞,停止加热. | F中: | |
| ④冷却后,称量G处总质量为54.2g. | ------ | ------ |
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使F中反应完全、G中吸收完全,也不会得出正确的结果.经讨论,有同学提出在F与G之间增加一个装置.再次实验后,得到了较正确的结果.那么原来实验所测得的铜的质量分数偏小的原因可能是
纯碱是重要的化工原料
(一)制备探究:如图是工业生产纯碱的主要流程示意图.
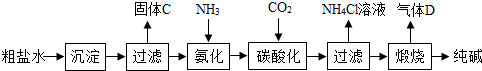
[查阅资料]
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2、CaCl2的化学方程式:
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(3)“碳酸化”后过滤获得的NH4Cl可用作
(4)煅烧制得纯碱的化学方程式是
(二)成分探究
[提出问题]纯碱样品中含有哪些杂质?
[猜想]猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;
猜想三:
[实验探究]确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下:
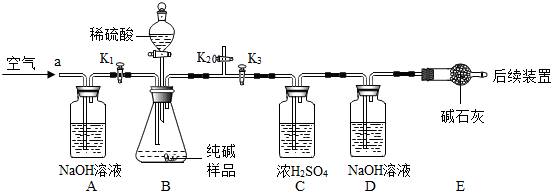
①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2,关闭K3,缓缓鼓入一段时间空气;
②关闭活塞K1和K2,打开K3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
[实验讨论]
(5)加入样品前还应
(6)装置A的作用是
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是
(8)装置B中生成CO2的质量为
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知Na2CO3相对分子质量为106、NaHCO3相对分子质量为84):
(9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足
查看习题详情和答案>>
(一)制备探究:如图是工业生产纯碱的主要流程示意图.

[查阅资料]
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2、CaCl2的化学方程式:
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
,CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
有利于溶液吸收CO2气体
有利于溶液吸收CO2气体
,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
.(3)“碳酸化”后过滤获得的NH4Cl可用作
氮
氮
肥,也可先加热
加热
(填“加热”或“冷却”)NH4Cl溶液,再加入熟石灰获得循环使用的物质是NH3(或氨气)
NH3(或氨气)
;(4)煅烧制得纯碱的化学方程式是
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
(二)成分探究
[提出问题]纯碱样品中含有哪些杂质?
[猜想]猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;
猜想三:
NaHCO3和NaCl
NaHCO3和NaCl
[实验探究]确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下:

①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2,关闭K3,缓缓鼓入一段时间空气;
②关闭活塞K1和K2,打开K3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
[实验讨论]
(5)加入样品前还应
检查装置气密性
检查装置气密性
;(6)装置A的作用是
除去空气中的二氧化碳
除去空气中的二氧化碳
,装置C的作用是除去二氧化碳中的水
除去二氧化碳中的水
;装置E的作用是吸收从D中带出的水
吸收从D中带出的水
;(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是
将生成的二氧化碳全部送到D中
将生成的二氧化碳全部送到D中
,装置B中一定发生的化学反应方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
装置D中的化学反应方程式为CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
.(8)装置B中生成CO2的质量为
4.84
4.84
g.通过计算说明纯碱中A
A
含NaHCO3(填字母).A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知Na2CO3相对分子质量为106、NaHCO3相对分子质量为84):
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
=
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
| 106 |
| 10.6g |
| 44 |
| x |
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠.
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
=
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
| 106 |
| 10.6g |
| 44 |
| x |
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠.
(9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足
W>0.32a
W>0.32a
条件时,样品中含有NaCl.