摘要:32.CO和CO2的混合气体10g与足量灼热的氧化铜反应后.测得质量比原来增加4g.则原混合气体中CO和CO2的质量比为 .
网址:http://m.1010jiajiao.com/timu3_id_108919[举报]
28、如图两装置都能用于气体体积的测定
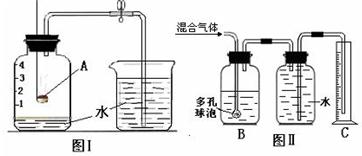
请你回答:
(1)图I是为了测定空气中氧气的含量.物质A为
(2)实验室有一瓶CO和CO2的混合气体,小华同学计划用Ⅱ图装置粗略测定混合气体中CO的体积分数.其中B瓶装有足量的
查看习题详情和答案>>

请你回答:
(1)图I是为了测定空气中氧气的含量.物质A为
红磷
;冷却至室温后打开止水夹,能观察到的现象是
水沿导管进入集气瓶,最后约停在刻度1处.
.(2)实验室有一瓶CO和CO2的混合气体,小华同学计划用Ⅱ图装置粗略测定混合气体中CO的体积分数.其中B瓶装有足量的
NaOH
溶液,反应的化学方程式是
2NaOH+CO2=Na2CO3+H2O
.实验结束后量筒中的水的体积约为
CO
气体的体积.将7.2克CO和CO2的混合气体缓缓通入足量灼热的氧化铜(假设反应进行完全),得到6.4克铜,并把反应后的气体全部通入足量的澄清石灰水中,会得到一种白色沉淀.求:
(1)原反应物中CO和CO2各多少克?
(2)白色沉淀的质量为多少克?
查看习题详情和答案>>
(1)原反应物中CO和CO2各多少克?
(2)白色沉淀的质量为多少克?
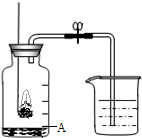 空气是一种宝贵的自然资源.空气中主要含有氮气和氧气.如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水.做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸人瓶中并把塞子塞紧.待红磷熄灭后.发现红磷还有剩余,冷却,打开弹簧夹.烧杯中的水倒流进集气瓶中.液面上升到图中A的位置.
空气是一种宝贵的自然资源.空气中主要含有氮气和氧气.如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水.做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸人瓶中并把塞子塞紧.待红磷熄灭后.发现红磷还有剩余,冷却,打开弹簧夹.烧杯中的水倒流进集气瓶中.液面上升到图中A的位置.(1)从上述实验现象可知:氧气约占空气总体积的1/5,氮气约为4/5.能够得到该结论主要是运用了氮气的有关性质,请写出其中两点:
①
②
(2)红磷燃烧的化学方程式是
(3)实验室有一瓶CO和CO2的混合气体,某同学计划用上图装置(无燃烧匙)测定该混合气体中CO和CO2的体积比.烧杯中应装入
取一定质量的CO和CO2的混合气体,通入到足量的Ba(OH)2溶液中,充分反应后过滤,测得生成的沉淀和所取的混合气体的总质量相等.则原混合气体中碳原子和氧原子的个数比为( )
| A、1:1 | B、2:3 | C、153:28 | D、181:209 |
 钢铁是使用最多的金属材料.
钢铁是使用最多的金属材料.(1)铁制品锈蚀的过程,实际上是铁与
氧气、水
氧气、水
发生化学反应的过程.铝比铁活泼,但铝具有很好的抗腐蚀性能,其原因是铝与空气中的氧气反应,表面形成致密的氧化铝薄膜
铝与空气中的氧气反应,表面形成致密的氧化铝薄膜
.(2)将磁铁矿(主要成分是Fe3O4)冶炼成铁的化学方程式是
4CO+Fe3O4
3Fe+4CO2
| ||
4CO+Fe3O4
3Fe+4CO2
.生铁冶炼成钢的过程中,含碳量适当
| ||
降低
降低
(选填“升高”或“降低”).(3)实验室模拟炼铁原理进行实验,得到的尾气是CO和CO2的混合气体.现欲利用如图装置将该混合气体进行分离,图中a、b、c、d均为活塞.
①检查装置的气密性.
甲、乙、丙装置内放入一定量水,使长导管口浸没在水面以下,关闭b、c,打开a、d,并在最右端导管口接注射器.当向外缓慢拉动注射器活塞时,如果整套装置气密性良好,则能观察到的现象是
甲、乙、丙装置内长导管口均有气泡冒出
甲、乙、丙装置内长导管口均有气泡冒出
.②分离CO和CO2的混合气体.
可供选择的试剂有:稀硫酸、浓硫酸、氢氧化钠溶液、澄清石灰水.
步骤Ⅰ:关闭b、c,打开a、d,缓缓通入混合气体,甲中发生反应的化学方程式为
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
;若乙装置中的现象是石灰水未变浑浊
石灰水未变浑浊
,说明甲装置中的反应是充分的;丙中试剂为浓硫酸
浓硫酸
.通过此步实验,分离出的气体是CO
CO
.步骤Ⅱ:关闭
a、d
a、d
,打开b、c
b、c
,让分液漏斗中的稀硫酸缓缓流下至不再产生气泡时,关闭b.通过此步实验,即可分离出另一种气体.(4)铁元素可以形成3种氧化物,分别是FeO、Fe2O3 和Fe3O4.取29g的固体样品,在高温时与足量CO充分反应,生成的气体被足量澄清石灰水吸收,得到50g沉淀.由此分析,原样品可能是
BD
BD
(选填字母).A.Fe2O3 B.Fe3O4 C.FeO和Fe3O4的混合物 D.Fe2O3和FeO的混合物.