摘要:[参考答案]答案:硫酸钠和硫酸(或Na2SO4 和H2SO4) (2) 实验操作 实验现象 实验结论 方案一:取少许反应后的 溶液置于试管中.向其中加入 碳酸钠 产生气泡(或红褐色固体逐渐溶解.溶液由无色变为黄色) 小亮的观点正确 方案二:取少许反应后的 溶液置于试管中.向其中加入 锌 产生气泡 (3)①氢离子和氢氧根离子反应生成了水分子 ②反应前的锌原子和铜离子变成了锌离子和铜原子 ③有新分子或新原子或新离子生成 [思维点拨]以实验探究的形势考查酸碱盐的知识.是近几年就为常见的典型题目.根据已知条件.有题目可知所探究的主题是“酸和碱的溶液能发生反应吗? .由于发生反应:2NaOH+H2SO4==Na2SO4+2H2O.无色酚酞溶液由红色变为无色.只能确定NaOH已反应完全.不能确定H2SO4是否过量.因此反应后的溶质除了有Na2SO4.还有可能有H2SO4,如果小亮的观点正确.就是说存在H2SO4.而检验H2SO4的方法有很多:如用碳酸钠.金属锌.石蕊等.第(3)问从微观角度分析反应实质:硫酸中存在自由移动的H+.SO42-.NaOH溶液中存在自由移动的Na+.OH-.反应后的溶液中仍然含有SO42- Na+.而H+.OH-不存在.说明反应中H+.OH-结合成H2O分子.通过分析揭示了化学反应的微观本质是有新的分子等粒子产生.
网址:http://m.1010jiajiao.com/timu3_id_10841[举报]
走进实验室,如果细心观察会有很多发现.小明就是这样一个很细心,善于提问,肯钻研的学生,以下是他记录的几个问题:
(1)有些玻璃仪器要经磨砂处理,而且磨砂部位不尽相同,如集气瓶磨砂面在瓶口的平面,而滴瓶磨砂面在颈部内壁,为什么?
(2)盛NaOH溶液的细口瓶上配的是橡皮塞,而装稀盐酸、稀硫酸的瓶子盖的是玻璃塞,为什么?
(3)硝酸银溶液盛放在棕色瓶中,为什么不用普通透明玻璃瓶盛放?
第1个问题,他认真思考后明白了,请帮助写下答案 .
后二个问题,他查阅资料,请教老师,知道了装NaOH溶液的瓶口如果盖玻璃塞,一段时间后,塞子与细口瓶粘连在一起,不易打开,因为玻璃中含有一种叫二氧化硅的物质,与CO2属同一类物质,请用化学方程式解释不易打开的原因并猜测生成物具有的性质 、 .
硝酸银溶液不稳定,在先照的条件下易分解,生成二氧化氮和氧气及一种单质,所以必须存放在棕色瓶中,写出此反应的化学方程式 .
查看习题详情和答案>>
(1)有些玻璃仪器要经磨砂处理,而且磨砂部位不尽相同,如集气瓶磨砂面在瓶口的平面,而滴瓶磨砂面在颈部内壁,为什么?
(2)盛NaOH溶液的细口瓶上配的是橡皮塞,而装稀盐酸、稀硫酸的瓶子盖的是玻璃塞,为什么?
(3)硝酸银溶液盛放在棕色瓶中,为什么不用普通透明玻璃瓶盛放?
第1个问题,他认真思考后明白了,请帮助写下答案
后二个问题,他查阅资料,请教老师,知道了装NaOH溶液的瓶口如果盖玻璃塞,一段时间后,塞子与细口瓶粘连在一起,不易打开,因为玻璃中含有一种叫二氧化硅的物质,与CO2属同一类物质,请用化学方程式解释不易打开的原因并猜测生成物具有的性质
硝酸银溶液不稳定,在先照的条件下易分解,生成二氧化氮和氧气及一种单质,所以必须存放在棕色瓶中,写出此反应的化学方程式
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应.这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入一块纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
无论是用5% H2SO4还是用10% H2SO4,均无明显现象.其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合.
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:Cl-能
假设二:SO42-能
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)
查看习题详情和答案>>
| 反应进程(分钟)\酸 | 1 | 2 | 5 | 15 | 20 |
| 10% HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 5% H2SO4 | 均无明显现象(无气泡) | ||||
| 10% H2SO4 | 均无明显现象(无气泡) | ||||
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:Cl-能
促进金属铝表面的氧化膜与H+反应
促进金属铝表面的氧化膜与H+反应
.假设二:SO42-能
对金属铝表面的氧化膜与H+反应对起阻碍作用
对金属铝表面的氧化膜与H+反应对起阻碍作用
.问题二:为了论证上述假设,你设计的实验方案是:(探究过程)
①向3支试管中分别加入5mL5%H2SO4溶液和已给铝片,向其中一支加入少量的Na2SO4晶体,无明显现象(同未加的对比);向另一支试管中加入少量的NaCl晶体,有气泡产生(同未加的对比).
②向2支试管中分别加入5mL10%HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4晶体,气泡立即明显减少(和另一支未加相比)
②向2支试管中分别加入5mL10%HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4晶体,气泡立即明显减少(和另一支未加相比)
①向3支试管中分别加入5mL5%H2SO4溶液和已给铝片,向其中一支加入少量的Na2SO4晶体,无明显现象(同未加的对比);向另一支试管中加入少量的NaCl晶体,有气泡产生(同未加的对比).
②向2支试管中分别加入5mL10%HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4晶体,气泡立即明显减少(和另一支未加相比)
.②向2支试管中分别加入5mL10%HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4晶体,气泡立即明显减少(和另一支未加相比)
36、在潜水员的面具里安装了盛有过氧化钠(Na2O2)的装置.过氧化钠是一种化学性质活泼的浅黄色固体粉末,在通常情况下,它能和CO2、H2O反应:2Na2O2+2H2O═4NaOH+O2↑、2Na2O2+2CO2═2Na2CO3+O2. 某课外兴趣小组为了探究过氧化钠和纯净的二氧化碳反应的产物,设计了如下图所示的实验装置(B、C、D、E中的样品或试剂分别为饱和碳酸氢钠溶液、浓硫酸、过氧化钠、饱和石灰水).
(1)装置A中放石灰石的玻璃仪器的名称是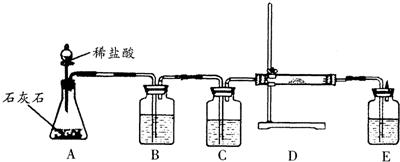
(2)C中浓硫酸的作用是
(3)检验Na2O2和CO2反应后生成的气体的方法是
(4)为了证明Na2O2和CO2反应后生成的固体是Na2CO3,请你设计一种合理的方案.
查看习题详情和答案>>
(1)装置A中放石灰石的玻璃仪器的名称是
锥形瓶
,装置B的作用可用化学方程式表示为NaHCO3+HCl═NaCl+H2O+CO2↑
.
(2)C中浓硫酸的作用是
除去二氧化碳中的水分
.(3)检验Na2O2和CO2反应后生成的气体的方法是
将带火星的木条放在E装置的玻璃管口,观察到木条复燃
.(4)为了证明Na2O2和CO2反应后生成的固体是Na2CO3,请你设计一种合理的方案.
要证明生成的碳酸钠,可以取反应后的固体,加入盐酸,然后将生成的气体通入澄清石灰水,观察到石灰水变浑浊,所以本题答案为:取反应后的固体,加入盐酸,然后将生成的气体通入澄清石灰水,观察到石灰水变浑浊.
.填写(1)和(2)中的空格,并以此为例,写出另外两个有颜色变化的化学反应实例.
(1)红褐色的氢氧化铁溶于稀硫酸变成
(2)澄清石灰水中滴入无色的碳酸钠饱和溶液生成
(3)
(4)
查看习题详情和答案>>
(1)红褐色的氢氧化铁溶于稀硫酸变成
棕黄
棕黄
色溶液.(2)澄清石灰水中滴入无色的碳酸钠饱和溶液生成
白
白
色沉淀.(3)
铜粉溶于无色硝酸银溶液变成蓝色溶液
铜粉溶于无色硝酸银溶液变成蓝色溶液
.(4)
向棕黄色氯化铁溶液中滴入氢氧化钠溶液生成 红褐 色沉淀.(其它合理答案也可)
向棕黄色氯化铁溶液中滴入氢氧化钠溶液生成 红褐 色沉淀.(其它合理答案也可)
.(2010?南开区一模)黄铜是由锌和铜形成的合金(合金可视为均一的混合物)有较强的耐磨性能,在生活中有广泛的用途.晓军同学为了测定黄铜屑样品的组成,分四次取样品与稀硫酸反应,其实验数据记录如下,其中过量的黄铜屑样品与稀硫酸反应的数据组是( )
|
查看习题详情和答案>>