摘要:[参考答案] 解:设生成0.64gO2需H2O2质量为X 2H2O2 MnO2 2H2O+O2↑ 68 32 x 0.64g----------------------------------- 68/x=32/0.64g x=1.36g------------------------------------------------------------ 瓶中已分解的过氧化氢质量:500g×30%-1.36g×500=14g 5g 答:瓶中已分解的过氧化氢质量是14g --------------------- [思维点拨]:通过化学方程式.根据反应后的产物氧气的量.来推到反应物纯的过氧化氢的量.然后再根据图表数据计算结果. 36. 0.2 钢中含碳量少.所以碳减少的质量.远小于铁转化为氧化物增加的质量 [思维点拨]此题目主要考查有关化学方程式的计算.(1)开始时烧杯和药品的总质量是25.7 g.反应完毕后烧杯和药品的总质量是25.2 g.所以反应中产生氢气的质量是:25.7 g-25.2=0.2g.----------------------------------------------- (2)设5.7g钢样品中含铁质量为X.则: Fe + 2HCl ======= FeCl2 + H2↑ 56 2 X 0.2g 56︰2== X︰0.2g X==5.6 g ------------------- 则这种钢样品含铁:×100%=98.2% (3)钢中含碳量少.灼烧后会生成二氧化碳气体.其中的铁转化为四氧化三铁.二氧化碳气体的质量远小于铁转化为氧化物增加的质量. 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_10792[举报]
分析:从表面看氧化钠似乎是溶质,其实它具有与水化合的性质,因此这里就隐蔽着氧化钠和水化合生成氢氧化钠的反应。可见真正溶质是氢氧化钠,其质量要通过计算才能得出。
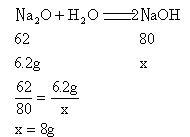 【解】设生成NaOH的质量为x
【解】设生成NaOH的质量为x
所得溶液中NaOH的质量分数为
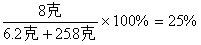 答案:(略)
答案:(略)
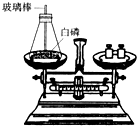 (1)如图所示为用加热后的玻璃棒点燃白磷,来测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验.
(1)如图所示为用加热后的玻璃棒点燃白磷,来测定白磷燃烧前后质量的变化情况,用来验证质量守恒定律的实验.①白磷在锥形瓶中燃烧时,常常导致瓶塞被冲开,实验失败.导致瓶塞被冲开的原因是什么?
②为了防止瓶塞被冲开,你能将实验作如何的改进?
③实验时,用加热后的玻璃棒点燃白磷,你还能找出其他方法点燃瓶内的白磷吗?
(2)已知工业上用电解氧化铝的方法制取单质铝的化学方程式为:2Al2O3
| ||
小倩和小明两位同学分别采用下面两种不同解法:
| 小倩同学的解法 | 小明同学的解法 | ||||||||||||
| 解:设生成的铝质量为X 2Al2O3
204108 10t X
X=5.3t 答:最多可生产5.3t铝 |
解:氧化铝中铝元素的质量分数为
铝的质量为10t×53%=5.3t 答:最多可生产5.3t铝 |
①你认为他们的解题思路和方法都正确吗?并说明理由.
②对“34g过氧化氢完全分解产生氧气质量为多少克?”一题,你认为也能用上述两种方法解答吗?并说明理由.
③请你把②的正确解法写出来.
下面是小华对一道题的错误解答,简述发生错误的原因,并加以改正.
题目:加热12.25g纯净的氯酸钾(KClO3),充分反应后可制得氧气多少克?
(1)错误原因:(2)改正:
解:设生成氧气的质量为X
KClO3
KCl+O2↑.
122.5 32
12.25g X
=
∴X═3.2g
答:加热12.25g KClO3,可制得氧气3.2g.
查看习题详情和答案>>
题目:加热12.25g纯净的氯酸钾(KClO3),充分反应后可制得氧气多少克?
(1)错误原因:(2)改正:
解:设生成氧气的质量为X
KClO3
| ||
122.5 32
12.25g X
| 122.5 |
| 12.25g |
| 32 |
| X |
∴X═3.2g
答:加热12.25g KClO3,可制得氧气3.2g.
小刚和小强同学对化学计算很有兴趣.以下是他们解答一道计算题的实录.请你一起参与完成相关问题.
[题目]将24.5g氯酸钾和4g二氧化锰混合后放入试管中加热,等完全反应后,停止加热,让试管冷却,称得试管内剩余固体的质量为ag.求生成氯化钾的质量.
小刚很快列出计算过程,求出了KCl的质量.请你帮他检查是否正确.
解:设生成的KCl为x
2KClO3═2KCl+O2↑
2×122.5 2×75.5
24.5 x
x=15.1g
答:生成的氯化钾的质量为15.1g.
上述过程是否有误? (填“是”或“否”)
若有,请重新利用化学方程式计算生成KCl的质量. 查看习题详情和答案>>
[题目]将24.5g氯酸钾和4g二氧化锰混合后放入试管中加热,等完全反应后,停止加热,让试管冷却,称得试管内剩余固体的质量为ag.求生成氯化钾的质量.
小刚很快列出计算过程,求出了KCl的质量.请你帮他检查是否正确.
解:设生成的KCl为x
2KClO3═2KCl+O2↑
2×122.5 2×75.5
24.5 x
x=15.1g
答:生成的氯化钾的质量为15.1g.
上述过程是否有误?
若有,请重新利用化学方程式计算生成KCl的质量. 查看习题详情和答案>>
实验室常用氯酸钾(化学式为KClO3)制取氧气,反应的化学方程式为2KClO3
2KCl+3O2↑.使2.45 g氯酸钾完全分解,某同学计算生成氧气质量的步骤如下:
解:设生成氧气的质量为x.
2 KClO3的相对分子质量总和为:2×39+35.5+16×3=161.5
2KClO3
2KCl+3O2↑
161.5 x
245 g 96
=
x=6328.16 g
答:生成氧气的质量为6328.16 g.
(1)除结果外,该同学计算过程中有两处明显的错误,分别是 、 .
(2)不通过化学方程式计算的方法,你还可以通过什么方法计算氧气的质量,请写出计算过程和结果 .
查看习题详情和答案>>
△ |
解:设生成氧气的质量为x.
2 KClO3的相对分子质量总和为:2×39+35.5+16×3=161.5
2KClO3
△ |
161.5 x
245 g 96
| 161.5 |
| 2.45g |
| x |
| 96 |
x=6328.16 g
答:生成氧气的质量为6328.16 g.
(1)除结果外,该同学计算过程中有两处明显的错误,分别是
(2)不通过化学方程式计算的方法,你还可以通过什么方法计算氧气的质量,请写出计算过程和结果