摘要: [参考答案]2溶液显碱性.CaCO3 难溶于水(或CaCO3和稀盐酸反应产生气体.Ca(OH)2与稀盐酸反应不会产生气体.合理即可 )(2)ⅠⅢ.方案Ⅰ若样品为混合物.地价稀盐酸也会产生气泡.因此无法确定该粉末就是CaCO3,若选方案Ⅲ Ca(OH)2 微溶于水.加水振荡后也会看到不溶物.滴入酚酞溶液也能变红.因此无法确定给粉末就是混合物.(3)取样品加入试管中.加水振荡.静置.上层清液中滴加石蕊溶液.溶液变蓝.倒出上层清液.在试管中滴加稀盐酸.有气泡产生. [思维点拨]该类题目在近几年各省市的中考题中比较常见.需要学生们的文字叙述较多.我们要用最为简练的语言表达清楚意思.最忌拖沓冗长.答不到点子上.
网址:http://m.1010jiajiao.com/timu3_id_10791[举报]
(2013?西城区一模)研究盐类物质的性质时,甲、乙、丙三位同学分别向NaHCO3溶液中滴加石灰水,均产生白色沉淀.他们分别设计实验方案,对自己过滤后的滤液中溶质的成分进行如下探究.
【实验准备】
用一定溶质的质量分数的NaHCO3溶液、NaOH溶液和Na2CO3溶液进行如下实验,为设计实验方案提供参考.
表中的现象Ⅰ为
【查阅资料】
(1)氯化钙溶液显中性.
(2)滤液中所含的溶质有以下几种可能:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH
【实验及分析】
甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3.
乙同学:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是NaOH和Ca(OH)2.
丙同学:分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,有白色沉淀产生;将另一支试管中的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊,则滤液中的溶质是Na2CO3和NaHCO3.
【反思与评价】
(1)老师认为乙、丙同学的实验方案和结论合理.
①丙同学的实验中,加入CaCl2溶液的目的是
②根据乙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是
(2)老师认为甲同学的实验方案和结论存在不足.丁同学通过以下实验帮助甲同学确认了滤液中溶质的成分.
(3)结合此次探究活动,你认为下列说法正确的是
a.盐溶液可能显碱性
b.化学反应的产物与反应物的量有关
c.碱和盐反应一定生成另外一种碱和另外一种盐
d.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量.
查看习题详情和答案>>
【实验准备】
用一定溶质的质量分数的NaHCO3溶液、NaOH溶液和Na2CO3溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入酚酞溶液 | 溶液变红 | 现象Ⅰ | 溶液变红 |
| 加入CuSO4溶液 | 产生气泡和蓝色沉淀 | 现象Ⅱ | 产生气泡和蓝色沉淀 |
| 加入CaCl2溶液 | 无明显变化 | 无明显变化 | 产生白色沉淀 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
溶液变红
溶液变红
;现象Ⅱ为产生蓝色沉淀,对应反应的化学方程式是CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
.【查阅资料】
(1)氯化钙溶液显中性.
(2)滤液中所含的溶质有以下几种可能:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH
【实验及分析】
甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3.
乙同学:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是NaOH和Ca(OH)2.
丙同学:分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,有白色沉淀产生;将另一支试管中的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊,则滤液中的溶质是Na2CO3和NaHCO3.
【反思与评价】
(1)老师认为乙、丙同学的实验方案和结论合理.
①丙同学的实验中,加入CaCl2溶液的目的是
检验Na2CO3
检验Na2CO3
.②根据乙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是
NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O
NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O
.(2)老师认为甲同学的实验方案和结论存在不足.丁同学通过以下实验帮助甲同学确认了滤液中溶质的成分.
| 实验操作 | 实验现象 | 实验结论 |
①取少量滤液于试管中,加入过量CaCl2溶液 ②过滤,向滤液中滴加CuSO4溶液 ①取少量滤液于试管中,加入过量CaCl2溶液 ②过滤,向滤液中滴加CuSO4溶液 |
①有白色沉淀生成 ②只产生蓝色沉淀,无气泡 ①有白色沉淀生成 ②只产生蓝色沉淀,无气泡 |
滤液中的溶质是Na2CO3和NaOH |
abd
abd
(填字母序号).a.盐溶液可能显碱性
b.化学反应的产物与反应物的量有关
c.碱和盐反应一定生成另外一种碱和另外一种盐
d.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量.
 (2013?海淀区二模)小明见妈妈买了些取暖袋,他很好奇,打开了一袋,发现里面是黑色的粉末.那么,取暖袋里是什么物质在发生反应、释放热量呢?
(2013?海淀区二模)小明见妈妈买了些取暖袋,他很好奇,打开了一袋,发现里面是黑色的粉末.那么,取暖袋里是什么物质在发生反应、释放热量呢?[查找资料]
①取暖袋由原料层、明胶层、无纺布袋三部分组成.原料层中的黑色粉末的主要成分是铁粉、活性炭、蛭石、可溶性无机盐、吸水性树脂(含水).
②蛭石是当今世界首屈一指的保温材料,起保温作用;吸水性树脂可反复释水、吸水,起吸水、保水的作用;二者均不参加反应.
③使用时应注意:不使用产品时请勿拆开密封包装.
[提出猜想]
①可溶性无机盐可能是氯化钠、硫酸钠、碳酸钠中一种或几种.
②取暖袋发热时,可能是铁粉、氧气、无机盐、水、活性炭几种物质间发生了化学反应.
[实验准备]
用NaCl溶液、Na2SO4溶液、Na2CO3溶液进行如下实验,为确定无机盐的成分提供参考.
| NaCl溶液 | Na2SO4溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 无明显变化 | 无明显变化 | 现象Ⅰ |
| 加入BaCl2溶液 | 无明显变化 | 产生白色沉淀 | 产生白色沉淀 |
| 加入AgNO3溶液 | 产生白色沉淀 | 溶液略呈浑浊 | 产生淡黄色沉淀 |
有气泡冒出
有气泡冒出
.(2)BaCl2溶液与Na2SO4溶液混合发生复分解反应,则白色沉淀的化学式为
BaSO4
BaSO4
.[实验过程]
分别取没有使用的取暖袋和失效后的取暖袋中的黑色粉末完成以下实验,探究无机盐的成分及参加反应的物质.
| 序号 | 加入试剂及操作 | 没有使用的暖袋 | 失效后的暖袋 |
I |
加入足量水观察 | 无色溶液,大量固体在烧杯底部 | 无色溶液,大量固体在烧杯底部 |
| Ⅱ | 取I中上层清液,向其中滴加盐酸 | 无变化 | 无变化 |
| Ⅲ | 取I中上层清液,向其中滴加BaCl2溶液 | 无变化 | 无变化 |
| Ⅳ | 取I中上层清液,向其中滴加AgNO3溶液 | 白色沉淀 | 白色沉淀 |
| Ⅴ | 另取黑色粉末加入足量盐酸 | 大量气泡,溶液呈浅绿色 | 无气泡,溶液呈黄色溶液 |
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.
(4)通过上述实验,可以得出以下结论:
①取暖袋中无机盐的成分是
氯化钠
氯化钠
.②取暖袋发热时,原料层中一定参加反应的物质是
铁粉
铁粉
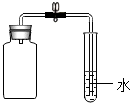
.(5)利用如图装置,设计实验方案探究氧气是否参加了反应:
在盛有氧气的集气瓶中加入潮湿的铁粉,过一段时间,水被倒吸
在盛有氧气的集气瓶中加入潮湿的铁粉,过一段时间,水被倒吸
,则氧气参加了反应. [反思与评价]
(6)小明根据IV中的现象判定无机盐未参加反应.他的结论是否合理,说明理由:
合理,因为失效以后还有白色沉淀
合理,因为失效以后还有白色沉淀
. (2012?北京)同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(2012?北京)同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.(1)实验装备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
有气泡产生
有气泡产生
,现象Ⅱ对应反应的化学方程式为Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
.(2)实验过程
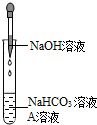
【实验1】证明反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如右图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是
CaCl2
CaCl2
.有同学提出这个实验不足以证明有Na2CO3生成,其理由是
CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀
CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀
.为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有
取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有
.【实验2】证明反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是
取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
.(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是
一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生
一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生
.研究盐类物质的性质时,甲、乙、丙三位同学分别向NaHCO3溶液中滴加石灰水,均产生白色沉淀.他们分别设计实验方案,对自己过滤后的滤液中溶质的成分进行如下探究.
【实验准备】
用一定溶质的质量分数的NaHCO3溶液、NaOH溶液和Na2CO3溶液进行如下实验,为设计实验方案提供参考.
| | NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 |
| 加入酚酞溶液 | 溶液变红 | 现象Ⅰ | 溶液变红 |
| 加入CuSO4溶液 | 产生气泡和蓝色沉淀 | 现象Ⅱ | 产生气泡和蓝色沉淀 |
| 加入CaCl2溶液 | 无明显变化 | 无明显变化 | 产生白色沉淀 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
【查阅资料】
(1)氯化钙溶液显中性.
(2)滤液中所含的溶质有以下几种可能:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH
【实验及分析】
甲同学:取少量滤液于试管中,滴加过量的稀盐酸,产生大量无色气泡,则滤液中的溶质是Na2CO3.
乙同学:取少量滤液于试管中,向其中通入少量CO2,产生白色沉淀,则滤液中的溶质是
NaOH和Ca(OH)2.
丙同学:分别取少量滤液于两支试管中,向一支试管中滴加CaCl2溶液,有白色沉淀产生;将另一支试管中的滤液加热至沸腾,将产生的气体通入澄清石灰水,澄清石灰水变浑浊,则滤液中的溶质是Na2CO3和NaHCO3.
【反思与评价】
(1)老师认为乙、丙同学的实验方案和结论合理.
①丙同学的实验中,加入CaCl2溶液的目的是 .
②根据乙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是 .
(2)老师认为甲同学的实验方案和结论存在不足.丁同学通过以下实验帮助甲同学确认了滤液中溶质的成分.
| 实验操作 | 实验现象 | 实验结论 |
| ① ② | ① ② | 滤液中的溶质是Na2CO3和NaOH |
(3)结合此次探究活动,你认为下列说法正确的是 (填字母序号).
a.盐溶液可能显碱性
b.化学反应的产物与反应物的量有关
c.碱和盐反应一定生成另外一种碱和另外一种盐
d.判断溶液混合后的成分不仅要考虑产物,还要考虑反应物是否过量. 查看习题详情和答案>>
(6分)同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应? 在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。
(1)实验准备
①查阅资料:NaHCO3+NaOH = Na2CO3+H2O Ca(OH)2+ Na2CO3 = CaCO3↓ + 2NaOH
CaCl2+2NaOH = Ca(OH)2↓(微溶)+ 2NaCl 2NaHCO3(溶液) Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
NaHCO3+HCl =NaCl+H2O+CO2↑ Ca(OH)2+NaHCO3 = CaCO3↓+NaOH+H2O
②前期实验:
用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
| | NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 |
| 加入稀盐酸 | 产生气泡 | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 溶液变浑浊 |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
证明NaOH溶液与NaHCO3溶液反应生成了Na2CO3
同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是_________________。 有同学提出这个实验不足以证明有Na2CO3生成,其理由是______________________________________。为了证明有Na2CO3生成,需要继续进行的操作是:取少量反应后的滤渣加入足量的 ___________ ,若产生无色气体证明有Na2CO3生成,反之则没有。

查看习题详情和答案>>