摘要:其他化合物 硝酸 HNO3 硫酸 H2SO4 盐酸 HCl 碳酸 H2CO3 硫化氢 H2S 氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜 Cu(OH)2 氢氧化钡 Ba(OH)2 氨水 NH3·H2O 氯化钠 NaCl 氯化铜 CuCl2 氯化铝 AlCl3 氯化钾 KCl 氯化亚铁 FeCl2 氯化铁 FeCl3 氯化银 AgCl 氯化钙 CaCl2 氯化镁 MgCl2 氯化钡 BaCl2 氯化锌 ZnCl2 硫酸铜 CuSO4 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钙 CaCO3 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸铁 Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铝 Al(NO3)3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸铵 (NH4)2 CO3 碳酸氢钠 NaHCO3 硫酸铁 Fe2(SO4)3 硫酸亚铁 FeSO4 硝酸银 AgNO3 硝酸钡 Ba(NO3)2 硝酸铵 NH4NO3 硫酸钡 BaSO4
网址:http://m.1010jiajiao.com/timu3_id_107505[举报]
小明学习了金属的活动顺序后,到实验室进行探究,他将一块金属钠投入到硫酸铜溶液中想得到铜,但却看到了另外的现象:没有红色的物质析出,却生成了大量的气体,并出现了蓝色的沉淀.小明想到了硫酸铜溶液中有水,又补充了另一个实验.并记录如下:
【分析】由上述现象可知:金属钠
【结论】据上述现象,小明又写出了金属钠投入到硫酸铜溶液中另一个产生沉淀的反应化学方程式
【反思】在金属活动顺序里,位于前面的金属不一定能把后面的金属从其他化合物的溶液中置换出来.
【拓展】将金属钠在空气中点燃后再放入充满CO2的集气瓶中,发现钠继续剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体.已知该反应为置换反应,发生的方程式为
查看习题详情和答案>>
| 操作步骤 | 实验现象 |
| ①将一小块钠放入盛水的烧杯中 | 金属溶解,剧烈反应,产生大量气体 |
| ②相反应后的烧杯中滴加酚酞试液 | 酚酞试液变红色 |
| ③将产生的气体收集并点燃 | 该气体能燃烧,并产生淡蓝色火焰 |
能
能
(填“能”或“不能”)与水反应,生成物中呈碱性的物质此处是NaOH
NaOH
(填“NaOH”或“Na2CO3”),其理由是化学反应前后元素的种类不变,而水中不含碳元素
化学反应前后元素的种类不变,而水中不含碳元素
.其反应的化学方程式为2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.【结论】据上述现象,小明又写出了金属钠投入到硫酸铜溶液中另一个产生沉淀的反应化学方程式
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
.【反思】在金属活动顺序里,位于前面的金属不一定能把后面的金属从其他化合物的溶液中置换出来.
【拓展】将金属钠在空气中点燃后再放入充满CO2的集气瓶中,发现钠继续剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体.已知该反应为置换反应,发生的方程式为
4Na+3CO2
C+2Na2CO3
| ||
4Na+3CO2
C+2Na2CO3
.这个实验使你对燃烧条件产生的新认识是
| ||
燃烧不一定需要氧气
燃烧不一定需要氧气
.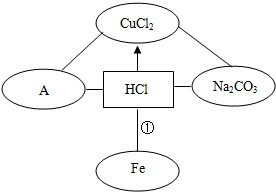 右图是关于盐酸化学性质的知识网络,-”表示相连的两种物质能发生反应,“”表示一种物质转化成另一种物
右图是关于盐酸化学性质的知识网络,-”表示相连的两种物质能发生反应,“”表示一种物质转化成另一种物质,A是含三种元素的化合物,与图中其他化合物不同类别.请完善这个知识网络:
(1)写出A的化学式
(2)反应①的化学方程式是
(3)根据该知识网络写出一个复分解反应化学方程式
小明学习了金属的活动顺序后,到实验室进行探究,他将一块金属钠投入到硫酸铜溶液中想得到铜,但却看到了另外的现象:没有红色的物质析出,却生成了大量的气体,并出现了蓝色的沉淀.小明想到了硫酸铜溶液中有水,又补充了另一个实验.并记录如下:
【分析】由上述现象可知:金属钠______(填“能”或“不能”)与水反应,生成物中呈碱性的物质此处是______(填“NaOH”或“Na2CO3”),其理由是______.其反应的化学方程式为______.
【结论】据上述现象,小明又写出了金属钠投入到硫酸铜溶液中另一个产生沉淀的反应化学方程式______.
【反思】在金属活动顺序里,位于前面的金属不一定能把后面的金属从其他化合物的溶液中置换出来.
【拓展】将金属钠在空气中点燃后再放入充满CO2的集气瓶中,发现钠继续剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体.已知该反应为置换反应,发生的方程式为______.这个实验使你对燃烧条件产生的新认识是______.
查看习题详情和答案>>
| 操作步骤 | 实验现象 |
| ①将一小块钠放入盛水的烧杯中 | 金属溶解,剧烈反应,产生大量气体 |
| ②相反应后的烧杯中滴加酚酞试液 | 酚酞试液变红色 |
| ③将产生的气体收集并点燃 | 该气体能燃烧,并产生淡蓝色火焰 |
【结论】据上述现象,小明又写出了金属钠投入到硫酸铜溶液中另一个产生沉淀的反应化学方程式______.
【反思】在金属活动顺序里,位于前面的金属不一定能把后面的金属从其他化合物的溶液中置换出来.
【拓展】将金属钠在空气中点燃后再放入充满CO2的集气瓶中,发现钠继续剧烈燃烧,发出白光,放热,产生一种白色固体和一种黑色固体.已知该反应为置换反应,发生的方程式为______.这个实验使你对燃烧条件产生的新认识是______.
通过对已学知识的对比和归纳,可以得出一些十分有趣的规律.这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读表中的内容,并回答相应的问题.
(1)由前两行内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的 数相等:
(2)由后两行内容对照可得出的规律是:通过元素或原子团的 可以确定相应化合物的化学式.
(3)利用表格中所给内容,请你再写出一种全都由非金属元素组成且含有原子团的化合物的化学式 .
(4)请你写出由H+、Na+、SO42-三种离子组成的物质的化学式 . 查看习题详情和答案>>
| 常见的几种离子 | H+ Na- Mg2+ OH- Cl- SO42 | ||
| 对应元素及原子团在化合物中的化合价 |  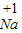     | ||
| 所能形成化合物的化学式 | 含有氢离子的化合物举例 | 含有氢氧根离子的化合物举例 | 其他化合物举例 |
| HCl、H2SO4 | NaOH、Mg(OH)2 | MgCl2、Na2SO4 | |
(2)由后两行内容对照可得出的规律是:通过元素或原子团的 可以确定相应化合物的化学式.
(3)利用表格中所给内容,请你再写出一种全都由非金属元素组成且含有原子团的化合物的化学式 .
(4)请你写出由H+、Na+、SO42-三种离子组成的物质的化学式 . 查看习题详情和答案>>
通过对已学知识的对比和归纳,可以得出一些十分有趣的规律.这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读表中的内容,并回答相应的问题.
| 常见的几种离子 | H+ Na- Mg2+ OH- Cl- SO42 | ||
| 对应元素及原子团在化合物中的化合价 | 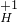 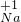 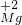 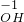 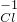 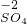 | ||
| 所能形成化合物的化学式 | 含有氢离子的化合物举例 | 含有氢氧根离子的化合物举例 | 其他化合物举例 |
| HCl、H2SO4 | NaOH、Mg(OH)2 | MgCl2、Na2SO4 | |
(2)由后两行内容对照可得出的规律是:通过元素或原子团的______可以确定相应化合物的化学式.
(3)利用表格中所给内容,请你再写出一种全都由非金属元素组成且含有原子团的化合物的化学式______.
(4)请你写出由H+、Na+、SO42-三种离子组成的物质的化学式______. 查看习题详情和答案>>