摘要:按下图进行实验.已知A为H2.CO中的一种或两者的混合物.甲装置中的黑色粉末为CuO.炭粉中的一种或两者的混合物. 根据下列要求.回答问题: (1)若黑色粉末是纯净物.甲.乙.丙装置中的固体或溶液依次出现红色.蓝色.浑浊.则气体A是 .黑色粉末为 . (2)若A为纯净物.反应现象与(1)同.则A是 .黑色粉末为 . 问中.乙装置的物质增重3.6g.丙装置中的物质增重4.4g.则至少需通入 g气体. 问中.甲装置生成6.4克红色物质.乙装置中物质增重0.9克.则至少需要 克黑色粉末.
网址:http://m.1010jiajiao.com/timu3_id_107498[举报]
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某兴趣小组用草酸晶 体制取CO,并进行了如下图所示实验。试回答:
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO。
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO。

(1)实验前应先 。
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是____、C中的试剂是___(填字母编号)。
a.浓硫酸
b.澄清的石灰水
c.氢氧化钠溶液
(3)F装置的作用是 。
(4)某同学认为图示装置有不足之处,改进的方法是 。
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是____、C中的试剂是___(填字母编号)。
a.浓硫酸
b.澄清的石灰水
c.氢氧化钠溶液
(3)F装置的作用是 。
(4)某同学认为图示装置有不足之处,改进的方法是 。
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C 杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy + y H2 x Fe + y H2O,Fe3C + 2H2
x Fe + y H2O,Fe3C + 2H2 3 Fe + CH4。
3 Fe + CH4。
(1)写出焙烧中氧化铁与CO反应的化学方程式: 。
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 。
 x Fe + y H2O,Fe3C + 2H2
x Fe + y H2O,Fe3C + 2H2 3 Fe + CH4。
3 Fe + CH4。(1)写出焙烧中氧化铁与CO反应的化学方程式: 。
(2)焙烧中加焦炭的作用除了可以生成CO外,还能 。
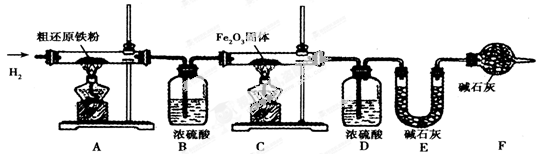
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验。已知3 CH4 + 4 Fe2O3 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
(3)主要实验步骤如下:
① 按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
② 点燃A 处酒精灯;
③ 缓缓通入纯净干燥的H2;
④ 点燃C 处酒精灯;
⑤ 分别熄灭A 处、C 处酒精灯;
⑥ 再缓缓通入少量H2;
⑦ 再次称量必要装置的质量。
操作的先后顺序是①→③→ →⑤→⑥→⑦( 填字母)
A.②→④ B.④→②
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;
(5)若缺少装置D,则所测氧元素的质量分数将 (填“偏大’’“偏小"或“不变")。
(6)粗还原铁粉样品的质量为20.000 g,装置B、E分别增重0.360 g和0.440 g,则计算样品出中碳元素的质量分数是 ,氧元素的质量分数是 。
查看习题详情和答案>>
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。(3)主要实验步骤如下:
① 按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
② 点燃A 处酒精灯;
③ 缓缓通入纯净干燥的H2;
④ 点燃C 处酒精灯;
⑤ 分别熄灭A 处、C 处酒精灯;
⑥ 再缓缓通入少量H2;
⑦ 再次称量必要装置的质量。
操作的先后顺序是①→③→ →⑤→⑥→⑦( 填字母)
A.②→④ B.④→②
(4)步骤③的目的是 ,验证该步骤目的达到的实验方法是 ;
(5)若缺少装置D,则所测氧元素的质量分数将 (填“偏大’’“偏小"或“不变")。
(6)粗还原铁粉样品的质量为20.000 g,装置B、E分别增重0.360 g和0.440 g,则计算样品出中碳元素的质量分数是 ,氧元素的质量分数是 。
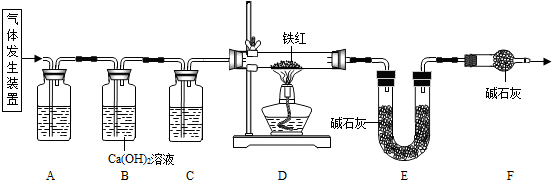
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验.

试回答:
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO.
(1)实验前应先______.
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是______、C中的试剂是______(填字母编号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是______.
(4)某同学认为图示装置有不足之处,改进的方法是______.
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+y H2 x Fe+y H2O,Fe3C+2H2
x Fe+y H2O,Fe3C+2H2 3Fe+CH4.
3Fe+CH4.
(1)写出焙烧中氧化铁与CO反应的化学方程式:______.
(2)焙烧中加焦炭的作用除了可以生成CO外,还能______.
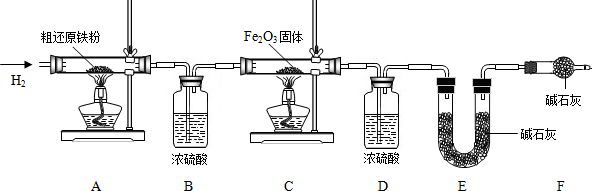
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.

已知3CH4+4Fe2O3 3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②点燃A处酒精灯;
③缓缓通入纯净干燥的H2;
④点燃C处酒精灯;
⑤分别熄灭A处、C处酒精灯;
⑥再缓缓通入少量H2;
⑦再次称量必要装置的质量.
操作的先后顺序是①→③→______→⑤→⑥→⑦(填字母)
A.②→④B.④→②
(4)步骤③的目的是______,验证该步骤目的达到的实验方法是______;
(5)若缺少装置D,则所测氧元素的质量分数将______(填“偏大’’“偏小“或“不变“,下同).
(6)粗还原铁粉样品的质量为20.000g,装置B、E分别增重0.360g和0.440g,则计算样品出中碳元素的质量分数是______,氧元素的质量分数是______.(无需计算过程).
查看习题详情和答案>>
探究一:工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.某兴趣小组用草酸晶体制取CO,并进行了如下图所示实验.
试回答:
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO.
(1)实验前应先
(2)进入D中的气体是纯净、干燥的CO,则A中试剂是
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是
(4)某同学认为图示装置有不足之处,改进的方法是
探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+y H2
x Fe+y H2O,Fe3C+2H2
3Fe+CH4.
(1)写出焙烧中氧化铁与CO反应的化学方程式:
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.
已知3CH4+4Fe2O3
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②点燃A处酒精灯;
③缓缓通入纯净干燥的H2;
④点燃C处酒精灯;
⑤分别熄灭A处、C处酒精灯;
⑥再缓缓通入少量H2;
⑦再次称量必要装置的质量.
操作的先后顺序是①→③→
A.②→④B.④→②
(4)步骤③的目的是
(5)若缺少装置D,则所测氧元素的质量分数将
(6)粗还原铁粉样品的质量为20.000g,装置B、E分别增重0.360g和0.440g,则计算样品出中碳元素的质量分数是
查看习题详情和答案>>

试回答:
【查阅资料】草酸晶体(H2C2O4?3H2O)在浓H2SO4作用下受热分解生成CO2和CO.
(1)实验前应先
检查装置的气密性
检查装置的气密性
.(2)进入D中的气体是纯净、干燥的CO,则A中试剂是
c
c
、C中的试剂是a
a
(填字母编号).a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)F装置的作用是
防止空气中二氧化碳、水蒸气进入E装置中
防止空气中二氧化碳、水蒸气进入E装置中
.(4)某同学认为图示装置有不足之处,改进的方法是
在F后用酒精灯点燃
在F后用酒精灯点燃
.探究二:精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+y H2
| ||
| ||
(1)写出焙烧中氧化铁与CO反应的化学方程式:
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(2)焙烧中加焦炭的作用除了可以生成CO外,还能
提供热量
提供热量
.【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按如下装置进行实验.

已知3CH4+4Fe2O3
| ||
(3)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②点燃A处酒精灯;
③缓缓通入纯净干燥的H2;
④点燃C处酒精灯;
⑤分别熄灭A处、C处酒精灯;
⑥再缓缓通入少量H2;
⑦再次称量必要装置的质量.
操作的先后顺序是①→③→
B
B
→⑤→⑥→⑦(填字母)A.②→④B.④→②
(4)步骤③的目的是
除去装置内的氧气,防止发生爆炸
除去装置内的氧气,防止发生爆炸
,验证该步骤目的达到的实验方法是收集尾气靠近燃着的酒精灯,听声音
收集尾气靠近燃着的酒精灯,听声音
;(5)若缺少装置D,则所测氧元素的质量分数将
不变
不变
(填“偏大’’“偏小“或“不变“,下同).(6)粗还原铁粉样品的质量为20.000g,装置B、E分别增重0.360g和0.440g,则计算样品出中碳元素的质量分数是
0.6%
0.6%
,氧元素的质量分数是1.6%
1.6%
.(无需计算过程).