网址:http://m.1010jiajiao.com/timu3_id_106947[举报]
氯化铵是一种氮肥.将氯化铵晶体与熟石灰粉末混合,会缓慢反应,加热时会较快地生成一种无色有刺激性气味的、密度比空气小的、易溶于水的氨气,同时生成氯化钙和水.试回答下列问题.
(1)写出氯化铵晶体与熟石灰粉末混合加热制取氨气的化学方程式:________.
(2)若用上述反应的方法制备氨气,可选用与________(制氢气、制氧气)相似的气体发生装置.氨气可以用________法收集.
(3)制得的NH3中常含水蒸气,为了得到干燥的氨气,可用
[ ]
A.浓H2SO4
B.NaOH固体
C.P2O5
D.碱石灰
查看习题详情和答案>>某兴趣小组的同学对一包在空气中敞口放置了一段时间的碱石灰产生了好奇,于是他们对这包碱石灰的成分展开了探究。
【提出问题 】他们要探究的问题是 。
【查阅资料 】①碱石灰是由CaO和NaOH固体混合而成,通常用于吸收二氧化碳及干燥气体。②熟石灰固体溶解度小,溶于水放出的热量少,可以忽略不计。
【提出猜想 】该碱石灰的主要成分可能含有CaO、NaOH、Ca(OH)2、CaCO3和 。
【实验探究 】小组的同学设计实验并进行验证,过程如下:
①小明取部分该碱石灰样品于试管中,加少量水后无放热现象,说明这包碱石灰样品中不含 。继续加足量水,振荡,静置后有白色沉淀,小明认为碱石灰样品中一定含有CaCO3,小美认为他的结论不准确,原因是 。(用化学方程式表示)
②从小明的试管中取少量上层清液于另一试管中,向其中滴加过量BaCl2溶液,有白色沉淀生成。
③把过程②所得物质过滤,向滤液中滴加无色酚酞溶液,溶液变红色。
【解释与结论 】根据以上探究:
①你认为该包碱石灰样品一定含有的物质是 ,可能含有的物质是 。
②实验探究过程③所得溶液中除酚酞外还含有的溶质是 。
【迁移应用】下列气体①氢气 ②氧气 ③一氧化碳 ④氯化氢 ⑤二氧化硫 ⑥氨气 ,不能用碱石灰干燥的是 (填字母序号)。
| A.①②③ | B.④⑤⑥ | C.④⑤ | D.⑤⑥ |
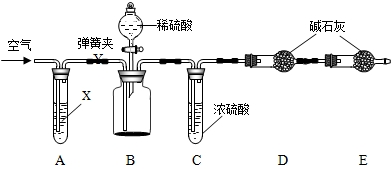
【查阅资料】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2.
(2)将生成的金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X.则为
【Na2CO3质量分数测定】
为进一步测定NaN3样品中Na2CO3的质量分数设计如下图装置(已知H2SO4溶液与NaN3,反应不生成气体).
实验步骤如下:
①按图连接装置,
②准确称得盛有碱石灰(固体氢氧化钠和氧化钙的混合物)的干燥管D的质量为a g;
③准确称得叠氮化钠(NaN3)样品的质量W g放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后再称得干燥管D的总质量为b g.根据实验中测得的有关数据,可以算出样品中碳酸钠的质量分数.
试回答:(1)第⑤步缓缓鼓入空气的目的是
(2)若没有C装置,则会导致测定结果
(3)E装置的作用是
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【查阅资料】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2.
(2)将生成的金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X.则为________,实验室检验该气体使用的试纸是湿润________.根据制备反应,工业级NaN3中会含有Na2CO3.试分析工业级NaN3中含有Na2CO3的可能原因________.
【Na2CO3质量分数测定】
为进一步测定NaN3样品中Na2CO3的质量分数设计如下图装置(已知H2SO4溶液与NaN3,反应不生成气体).
实验步骤如下:
①按图连接装置,________;
②准确称得盛有碱石灰(固体氢氧化钠和氧化钙的混合物)的干燥管D的质量为a g;
③准确称得叠氮化钠(NaN3)样品的质量W g放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后再称得干燥管D的总质量为b g.根据实验中测得的有关数据,可以算出样品中碳酸钠的质量分数.
试回答:(1)第⑤步缓缓鼓入空气的目的是________,装置A中试剂X最适宜选用________.写出B中生成气体的反应方程式________.
(2)若没有C装置,则会导致测定结果________(填:“偏大”或“偏小”).
(3)E装置的作用是________.
查看习题详情和答案>>
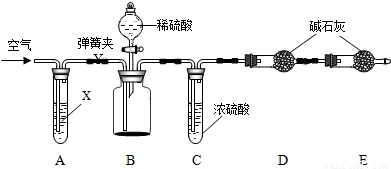
【查阅资料】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2.
(2)将生成的金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X.则为______,实验室检验该气体使用的试纸是湿润______.根据制备反应,工业级NaN3中会含有Na2CO3.试分析工业级NaN3中含有Na2CO3的可能原因______.
【Na2CO3质量分数测定】
为进一步测定NaN3样品中Na2CO3的质量分数设计如下图装置(已知H2SO4溶液与NaN3,反应不生成气体).
实验步骤如下:
①按图连接装置,______;
②准确称得盛有碱石灰(固体氢氧化钠和氧化钙的混合物)的干燥管D的质量为a g;
③准确称得叠氮化钠(NaN3)样品的质量W g放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后再称得干燥管D的总质量为b g.根据实验中测得的有关数据,可以算出样品中碳酸钠的质量分数.
试回答:(1)第⑤步缓缓鼓入空气的目的是______,装置A中试剂X最适宜选用______.写出B中生成气体的反应方程式______.
(2)若没有C装置,则会导致测定结果______(填:“偏大”或“偏小”).
(3)E装置的作用是______.
查看习题详情和答案>>