网址:http://m.1010jiajiao.com/timu3_id_105836[举报]
(1)若A、B混合,有白色沉淀产生,则C为______;
(2)若A、B混合,有气体放出,则C为______:
(3)若A、B混合,无任何现象,则C为______;
(4)上述(1)中发生的反应基本类型属于______反应.
(1)若A、B混合,有白色沉淀产生,则C为
(2)若A、B混合,有气体放出,则C为
(3)若A、B混合,无任何现象,则C为
(4)上述(1)中发生的反应基本类型属于
(1)若A、B混合,有白色沉淀产生,则C为;
(2)若A、B混合,有气体放出,则C为:
(3)若A、B混合,无任何现象,则C为;
(4)上述(1)中发生的反应基本类型属于反应. 查看习题详情和答案>>
“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=NH4HCO3该反应属于
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下
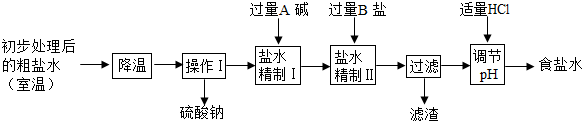
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.

②“精制I”操作中,加入过量含钙元素的碱的化学式是
③“精制II”操作中,加入B盐的有关反应方程式为
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| |
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3
| ||
氧化物、酸、碱、盐都是重要的无机化合物。请按要求回答下列一系列相关的问题。
(1)产生下列现象,只和空气中的水蒸气有关的是 ( )
A.固体烧碱要密封存放
B.生石灰长期在空气中放置会变质
C.浓硫酸露置于空气中会增重、变稀
D.铁制品放在潮湿空气中会生锈
(2)以下是一些食物的近似pH,对于胃酸过多的人比较适宜的食物是( )
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
(3)根据“性质决定用途,用途体现性质”回答下列问题。
A.稀释浓硫酸时,为什么不可将水倒进浓硫酸里?请简要解释其原因。
B.盐酸等许多酸都能使紫色石蕊试液变红,为什么?
C.写出用稀盐酸除水垢(主要成分是碳酸钙)的化学方程式。
(4)三支试管中分别装有少量白色固体,它们分别是氯化钠、氢氧化钠、碳酸钙中的一种,只要加入足量的 就能将它们一次性鉴别出来;
(5)实验操作考试时某同学做了如下两个实验:①氧化铜与稀硫酸反应;②烧碱溶液与酚酞溶液反应。实验结束后,该同学发现废液缸中有蓝色沉淀。请你写出有蓝色沉淀生成的反应的化学方程式是 。
 (6)右图是浓盐酸试剂瓶上标签的部分内容。请回答:
(6)右图是浓盐酸试剂瓶上标签的部分内容。请回答:
A.现要配制9%的稀盐酸120g,需要这种浓盐酸 g;
B.浓盐酸使用一段时间后溶质质量分数变小的原因是什么?
C.某固体氢氧化钠在空气中敞口放置一段时间后部分变质,将该固体取10 g加入质量分数为9%的盐酸至不再产生气泡为止,共产生气体质量为2.2g,试计算未变质的氢氧化钠的质量为多少克?
查看习题详情和答案>>