网址:http://m.1010jiajiao.com/timu3_id_105104[举报]
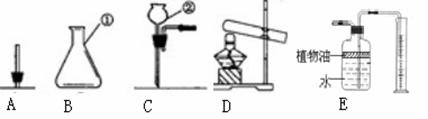
实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验。
(2)粗略测定加热2 g高锰酸钾所收集到的氧气体积。
(1)写出加热高锰酸钾制氧气的化学方程式:
细铁丝在氧气中燃烧化学方程式:__________ ______。
(2)装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)
a→( )( ) →d
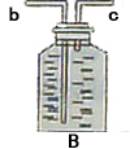
(3)实验过程发现B瓶中的水变红了,原因是:____________ ___
(4)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作可能是:
____________________________________________________________
(5)铁丝在氧气中燃烧实验中
①铁丝为什么要绕成螺旋状? 。
②铁丝前端为什么要系一根火柴? 。
③点燃火柴后,铁丝插入集气瓶中的适宜时刻是 。
(6)为何铁丝要由上而下缓慢伸入集气瓶中 。
(7)在研究“适于制取氧气的物质及其反应条件”的过程中,某同学完成了下表所示系列实验:
| 序号 | 实验 | 能否生成氧气 |
| A | 加热高锰酸钾 | 能 |
| B | 加热二氧化硅 | 不能 |
| C | 加热氯化钠 | 不能 |
| D | 加热水 | 不能 |
| E | 电解水 | 能 |
①根据实验A、B、C,可以得出的结论是:在一定条件下, ;
② 根据实验D、E,可以得出的结论是: 是影响物质能否反应产生氧气的重要因素;
查看习题详情和答案>>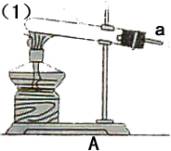

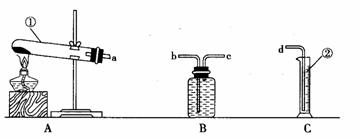
实验目的:
(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验;
(2)粗略测定加热2g高锰酸钾所收集到的氧气体积。
反应原理:(用文字表达式表示)
仪器认识:写出仪器(1)(2)的名称:
(1)__________________
(2)__________________
装置连接:为达到实验目的(2),各装置的正确连接顺序是(填接口的字母)a ( )( ) d
问题分析:(1)实验过程中发现B瓶中的水变红了,原因是______________________________________________________;(2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的原因可能是:______________________________________________________。
查看习题详情和答案>>
实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:
【查阅资料】:
1、NH4Cl和NaNO2反应生成NaCl、H2O及N2,并放出大量热量;
2、20℃时,NH4Cl的溶解度约为37g;
3、N2难溶于水,实验条件下,密度为1.25g·L—1。
【实验步骤】:
① ;
②20℃时,取0.78g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为V mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】:
(1)写出装置中仪器的名称:a、 ;b、 ;
(2)反应的化学方程式为: ;
(3)完善实验步骤中的所缺部分:① ;
(4)步骤④中,移走酒精灯的目的是 ;
(5)NH4Cl是一种 (填“易溶”、“可溶”、“微溶”、“难溶”)物质。20℃时,其饱和溶液中溶质质量分数为 。根据实验数据计算,生成氮气约为多少毫升?(3分,计算过程中,中间数据保留2位小数,最终结果为整数;相对分子质量:Mr-NH4Cl:53.5、Mr-N2:28)
(6)根据计算结果,步骤⑥中V的数值为 ;
(7)实验中,实际测得氮气的体积偏大,可能原因是 。
A.实验中加入饱和NaNO2溶液的体积也被作为生成N2的体积
B.装置漏气
实验室有一标签残缺的盐酸,请你来探究。
(1)若确定它不是浓盐酸的方法是 。
(2)粗略测定每毫升盐酸中含溶质HCl的质量。同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第一步:在小烧杯中加入8g5%的氢氧化钠溶液;滴入2滴酚酞试液;
第二步:向10mL的量筒里注入该盐酸至一定刻度,记下读数V1;
第三步:用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,直至到溶液由红色刚刚变为无色为止;
第四步:记录并整理数据;
第五步:计算,确定每毫升盐酸中含溶质HCl的质量。
请根据以上实验过程,回答下面问题:
① 写出盐酸和氢氧化钠发生中和反应的化学方程式 。
② 本实验要用指示剂的目的是 。
③ 第三步的操作缺少两个重要环节,请你补充完整。
、 。
④ 如量筒中剩余盐酸的体积为V2 mL,则每毫升盐酸中含溶质HCl的质量是
g。
(3)测定每毫升盐酸中含溶质HCl的质量的方法还有许多,请你写出一种其他可行的方法。(要求:与上述方法的原理不同、简述所依据的原理和要测定的数据。)
查看习题详情和答案>> 现科学探究的重要途径。请回答以下有关问题:
现科学探究的重要途径。请回答以下有关问题: