摘要:在“生石灰.淀粉.活性炭.氧化铁.二氧化碳.小苏打.汞 中选择适当物质填空: (1)可作气体肥料的是 (2)可作某些食品干燥剂的是 (3)用于温度计的是 (4)能做发酵粉的是 (5)用于防毒面具的是 (6)赤铁矿主要成分是 (7)大米.小麦中的主要物质是
网址:http://m.1010jiajiao.com/timu3_id_10340[举报]
在“生石灰、淀粉、活性炭、氧化铁、二氧化碳、小苏打、硝酸铵”中选择适当物质填空:
(1)可作气体肥料的是
(2)可作某些食品干燥剂的是
(3)溶于水溶液温度降低的是
(4)能做发酵粉的是
(5)用于防毒面具的是
(6)赤铁矿主要成分是
(7)大米、小麦中的主要物质是
查看习题详情和答案>>
(1)可作气体肥料的是
二氧化碳
二氧化碳
(2)可作某些食品干燥剂的是
生石灰
生石灰
(3)溶于水溶液温度降低的是
硝酸铵
硝酸铵
(4)能做发酵粉的是
小苏打
小苏打
(5)用于防毒面具的是
活性炭
活性炭
(6)赤铁矿主要成分是
氧化铁
氧化铁
(7)大米、小麦中的主要物质是
淀粉
淀粉
.在“生石灰、淀粉、活性炭、氧化铁、二氧化碳、小苏打、硝酸铵”中选择适当物质填空:
(1)可作气体肥料的是______
(2)可作某些食品干燥剂的是______
(3)溶于水溶液温度降低的是______
(4)能做发酵粉的是______
(5)用于防毒面具的是______
(6)赤铁矿主要成分是______
(7)大米、小麦中的主要物质是______.
查看习题详情和答案>>
在“生石灰、淀粉、活性炭、氧化铁、二氧化碳、小苏打、硝酸铵”中选择适当物质填空:
(1)可作气体肥料的是______
(2)可作某些食品干燥剂的是______
(3)溶于水溶液温度降低的是______
(4)能做发酵粉的是______
(5)用于防毒面具的是______
(6)赤铁矿主要成分是______
(7)大米、小麦中的主要物质是______.
查看习题详情和答案>>
(1)可作气体肥料的是______
(2)可作某些食品干燥剂的是______
(3)溶于水溶液温度降低的是______
(4)能做发酵粉的是______
(5)用于防毒面具的是______
(6)赤铁矿主要成分是______
(7)大米、小麦中的主要物质是______.
在“生石灰、淀粉、活性炭、氧化铁、二氧化碳、小苏打、硝酸铵”中选择适当物质填空:
(1)可作气体肥料的是______
(2)可作某些食品干燥剂的是______
(3)溶于水溶液温度降低的是______
(4)能做发酵粉的是______
(5)用于防毒面具的是______
(6)赤铁矿主要成分是______
(7)大米、小麦中的主要物质是______.
查看习题详情和答案>>
(1)可作气体肥料的是______
(2)可作某些食品干燥剂的是______
(3)溶于水溶液温度降低的是______
(4)能做发酵粉的是______
(5)用于防毒面具的是______
(6)赤铁矿主要成分是______
(7)大米、小麦中的主要物质是______.
查看习题详情和答案>>
(2012?连云港)一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
【资料获悉】铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的.
【教师指导】铁被氧气氧化最终产物为红棕色的Fe2O3(其他产物忽略不计).
【探究目的】小组同学欲探究该“脱氧剂”是否已经失效(即单质铁是否已经完全被氧化),并测定各成分的质量分数,设计了以下探究实验.
【实验探究】
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体.
步骤2:称取10.00g样品与一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为7.28g.
步骤3:按如下装置,将得到的7.28g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.15g.
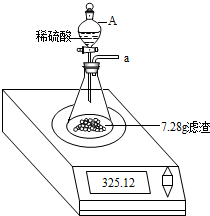
步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20g.
【交流讨论】
(1)由步骤1得出的结论是
(2)步骤2目的是
(3)步骤3中仪器A的名称为
小明认为0.15g差值即为H2的质量,并由此计算出样品中单质铁的质量为4.20g.
小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由是
(4)如果步骤4中滤渣没有经过洗涤,则称得的质量
【教师指导】样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe2(SO4)3反应消耗铁的质量总和.
【学生实验】小红将步骤3的装置进行了改进,重新称取10.00g样品进行实验,并准确测得固体与足量稀硫酸反应前后总质量差为0.14g.
【数据处理】由于反应过程较复杂,小组同学在老师的帮助下,推算出与Fe2(SO4)3反应消耗铁的质量为0.56g.
【请你参与】
(1)写出Fe2O3与稀硫酸反应的化学方程式.
(2)请根据以上数据,计算该样品中各成分的质量分数.
查看习题详情和答案>>
【资料获悉】铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的.
【教师指导】铁被氧气氧化最终产物为红棕色的Fe2O3(其他产物忽略不计).
【探究目的】小组同学欲探究该“脱氧剂”是否已经失效(即单质铁是否已经完全被氧化),并测定各成分的质量分数,设计了以下探究实验.
【实验探究】
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体.
步骤2:称取10.00g样品与一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为7.28g.
步骤3:按如下装置,将得到的7.28g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.15g.

步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20g.
【交流讨论】
(1)由步骤1得出的结论是
样品中含有单质的铁
样品中含有单质的铁
.(2)步骤2目的是
溶解样品中氯化钠
溶解样品中氯化钠
,检验该滤液中溶质的方法是取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠
取少量滤液于试管中,滴加硝酸银溶液,产生白色沉淀,说明溶质为氯化钠
.(3)步骤3中仪器A的名称为
分液漏斗
分液漏斗
.小明认为0.15g差值即为H2的质量,并由此计算出样品中单质铁的质量为4.20g.
小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由是
防止氢气排出时带出一部分水,使得氢气质量增加,减少对氢气质量的测定产生的误差
防止氢气排出时带出一部分水,使得氢气质量增加,减少对氢气质量的测定产生的误差
.(4)如果步骤4中滤渣没有经过洗涤,则称得的质量
>
>
1.20g(填“>”或“=”或“<”)【教师指导】样品在稀硫酸中除了Fe、Fe2O3分别能与稀硫酸反应外,还存在反应:Fe+Fe2(SO4)3=3FeSO4.因此,小明用产生H2的质量计算样品中铁的质量不合理.实际上,样品中单质铁的质量应该是与酸反应消耗的铁和与Fe2(SO4)3反应消耗铁的质量总和.
【学生实验】小红将步骤3的装置进行了改进,重新称取10.00g样品进行实验,并准确测得固体与足量稀硫酸反应前后总质量差为0.14g.
【数据处理】由于反应过程较复杂,小组同学在老师的帮助下,推算出与Fe2(SO4)3反应消耗铁的质量为0.56g.
【请你参与】
(1)写出Fe2O3与稀硫酸反应的化学方程式.
(2)请根据以上数据,计算该样品中各成分的质量分数.