摘要:1.知识结构 2.重点概念和含义与应用 (1)物理性质和化学性质 研究物质时首先从认识物质开始.而最先是认识物质的物理性质和化学性质.物理性质主要包括:物质的颜色.状态.气味.味道.溶解性.熔点.沸点.密度.硬度.传热导电能力等.有时把一些物质的特殊性质如腐蚀性.毒性等也归在物理性质里.化学性质上前学习到的如物质对热的稳定性.氧化还原性.酸碱性等. 物质的性质是中学化学学习的重点.对重要物质的物理性质和化学性质必须牢固地掌握.实际上中学化学是以学习物质性质为中心.物质的性质可以反映出该物质的组成结构.并决定了该物质的用途.制法和检验方法等.它跟物质的结构和元素化合物中的某些知识的内在联系可表示如下: 从图表中可以看出.物质性质的重要性. (2)物理变化和化学变化 对物质性质的认识除了能直接感观外.一般需通过变化才能进一步地认识.在物质发生变化时若没有生成新物质.即构成物质的分子没有改变.这种变化叫做物理变化.如水的“三态 变化,若有新物质生成.即分子发生了改变生成新物质的分子.叫做化学变化.如把水通电分解生成氢气和氧气.物质发生化学变化时.一般会伴随一些现象.如发光.放热.变色等.可以帮助判断化学变化的发生与否. 对物质的变化.要求会判断. (3)化合反应.分解反应.置换反应.复分解反应 这是从物质的组成上看化学反应前后与化学反应后物质的种类有何变化.分成四种基本反应类型.要理解每种反应类型的反应实质.还在掌握每种反应类型的发生条件.如金属跟酸及金属跟盐反应时.需要熟记金属活动性顺序及其应用,复分解反应时.需要掌握发生条件及酸.碱.盐的溶解性表及其应用. (4)氧化反应和还原反应 初中是把化学反应中.有无氧元素的参与定为氧化反应和还原反应的.实际上这两个反应同时发生.故称氧化还原反应.反应中引出一系列的概念:氧化剂.还原剂.氧化性.还原性.被氧化.被还原.这些概念都是对反应物而言.另有氧化产物和还原产物.这是对生成物而言.本部分知识到高中还需进一步深化与提高. 还应注意.氧化还原反应与四个基本反应类型的关系.是从不同角度把化学反应分类的.它们属于并列关系. (5)金属活动性顺序 人们经过长期的实践.总结出常见金属的化学活动性顺序: 金属活动性由强逐渐减弱 能转换出酸里的氢不能转换出酸里的氢 要掌握金属活动性顺序的应用. (6)催化剂和催化作用 理解催化剂概念时.要注意以下几点: ①催化剂能改变其它物质的化学反应速率.改变既可以是加快.也可以是减慢.都叫催化剂. ②催化剂在化学反应前与化学反应后它的质量和化学性质不变.这里没有涉及化学反应的过程.实际上催化剂参与化学反应的过程.只是“两头 没变. ③二氧化锰在加热氯酸钾制氧气的反应中是催化剂.不是说二氧化锰在任何反应中都是催化剂. (7)质量守恒定律 这是从量的变化上理解化学反应的实质.也在配平化学方程式和化学计算的理论依据.要从微观上分析.理解化学反应的实质.是参加反应的各种物质的原子重新组成新物质的过程.即在化学反应的前后原子的种类.原子的数目及每个原子的质量都没有改变.所以化学反应前后物质的总质量相等. 要着重理解质量守恒定律中的“参加 和“总和 是指什么?“参加 是指对反应物中没有参加反应的物质的质量不能计入.这就给含杂质及已知反应物的两个量时要以“少的量 的计算打下基础.“总和 是对生成物而言.这时生成物质若是气体或沉淀时.不要忽略.要计入生成物的总量中去. (8)电离 这是研究某些化合物溶于水后能够导电.引出来的一个概念.到高中此部分知识还要进一步加深与提高. 凡是溶于水或熔化后能导电的化合物称为电解质.电解质溶于水时.离解成自由移动的离子的过程叫做电离. 要着重理解在电解质溶液里.所有阳离子带的正电荷总数与所有阴离子带的负电荷总数相等.所以.整个溶液不显电性.
网址:http://m.1010jiajiao.com/timu3_id_103045[举报]
(2006?乐山)物质的组成--结构--性质--变化有着密切的关系,这种关系是化学知识的基本结构.下列关于反应4
+3
2
2
(注:0、+3、-2表示元素化合价)所进行的判断推理中,正确的是( )
①氧气使铝发生氧化反应,故氧气具有氧化性
②反应中,铝元素的化合价由0价变为+3价,氧元素的化合价则降低为-2价.
③氧气具有氧化性是因为氧原子最外层电子数为6,在化学反应中易得电子,元素化合价降低
④金属铝原子在化学反应中失去电子,被氧化,其元素化合价升高,故铝具有还原性.
| 0 |
| Al |
| 0 |
| O |
| ||
| +3 |
| Al2 |
| -2 |
| O3 |
①氧气使铝发生氧化反应,故氧气具有氧化性
②反应中,铝元素的化合价由0价变为+3价,氧元素的化合价则降低为-2价.
③氧气具有氧化性是因为氧原子最外层电子数为6,在化学反应中易得电子,元素化合价降低
④金属铝原子在化学反应中失去电子,被氧化,其元素化合价升高,故铝具有还原性.
查看习题详情和答案>>
(2012?塘沽区二模)下列现象或事实,用分子、原子的相关知识加以解释,其中错误的是( )
|
查看习题详情和答案>>
10、丁酸是无色透明油状液体,有腐臭的酸味;乙酸乙酯是无色透明易挥发的液体,有果香味,易燃.但是,丁酸和乙酸乙酯的化学式都为C4H8O2.请用所学的结构、性质等知识分析下列认识中正确的是( )
查看习题详情和答案>>
(1)化学基础知识是学好化学的关键,请按下列要求填空.
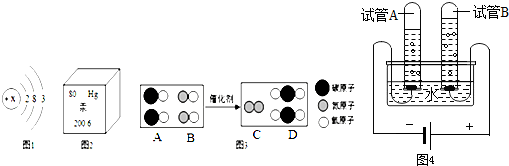
①图1是某微粒的结构示意图.该微粒在化学反应中失去电子后形成粒子的符号 .
②写出一条从图2中获得的信息 .
③如图3所示是汽车尾气治理过程中某反应的微观示意图.则A和C的质量比为 .
(2)水是生命的源泉,也是不可缺少的资源
①自然界的水常常遭到人为污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指 ;(填字母)
A.元素 B.原子 C.离子 D.分子
②净水器常用活性炭,主要是利用活性炭的 性.生活中,既能降低水的硬度,又能杀菌消毒的方法是 .
③电解水的装置如图4所示,管A,管B中的气体质量比是 ,在电解水过程中,保持不变的粒子是 .
(3)铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
①按人类开始使用这三种金属的先后排序为 (用元素符号表示)
②在空气中 制品(填“铝”或“铁”)更耐腐蚀.
③用下列试剂验证这三种金属的活动性顺序,能达到目的是 (填序号)
A.硫酸铝溶液 B.硫酸亚铁溶液 C.稀硫酸.
查看习题详情和答案>>

①图1是某微粒的结构示意图.该微粒在化学反应中失去电子后形成粒子的符号
②写出一条从图2中获得的信息
③如图3所示是汽车尾气治理过程中某反应的微观示意图.则A和C的质量比为
(2)水是生命的源泉,也是不可缺少的资源
①自然界的水常常遭到人为污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指
A.元素 B.原子 C.离子 D.分子
②净水器常用活性炭,主要是利用活性炭的
③电解水的装置如图4所示,管A,管B中的气体质量比是
(3)铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
①按人类开始使用这三种金属的先后排序为
②在空气中
③用下列试剂验证这三种金属的活动性顺序,能达到目的是
A.硫酸铝溶液 B.硫酸亚铁溶液 C.稀硫酸.