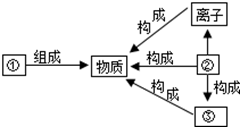
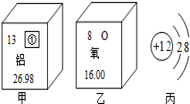
摘要:1.知识结构 2.重点概念的含义与应用 (1)分子 从微观上研究物质时引入的一个概念.是保持物质化学性质的一种粒子.分子很小但有一定的质量.分子在永恒地运动.分子之间有间隔.同种物质分子性质相同.不同种物质分子性质不同. 由分子构成的物质有:大多数非金属单质和非金属氧化物.硫化物.氯化物.氢化物.含氧酸.大多数有机物等. (2)原子 也是从微观上研究物质时引入的一个概念.是化学变化中的最小粒子.即在化学变化中它不能再分. 由原子构成的物质有:金属单质.极少数非单质. (3)离子 从微观上研究化合物时引入的一个概念.离子是带电的原子或原子团.带正电荷的离子叫阳离子.如H+. Mg2+.NH4+等,带负电荷的离子叫阴离子.如Cl-.S2-.OH-.SO42-等. 由离子构成的物质有:碱类和大多数的盐. (4)元素 从宏观上认识物质时.分析是由哪些基本物质形成的.引出来的一个宏观上的概念.元素的具有相同核电荷数的一类原子的总称.此概念应用于物质的宏观组成. (5)原子的组成 原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成.原子核由质子和中子构成.每个质子带1个单位正电荷.中了不带电.故原子核所带的正电荷数等于核内质子数. 在含有多个电子的原子里.核外电子是按能量分层排布的.把能量最低.离核最近的叫第一层.能量稍高.离核稍远的叫第二层.由里往外依次类推.叫三.四.五.六.七层.每层最多容纳的电子数目是一定的.第一层为2个.第二层为8个.第三层为18个┅┅.但是.最外层电子数目不超过8个. 金属元素.非金属元素.稀有气体元素的原子最外层电子数有明显的特点:金属元素原子的最外层电子数目一般少于4个.非金属元素原子的最外层电子数目一般多于或等于4个.稀有气体元素原子的最外层电子数目都是8个(氦只有一层电子.所以是2个).通常认为这种最外层有8个电子的结构叫做稳定结构.这里所说的稳定是相对的.不是绝对的. 在构成原子的各种粒子中.质子数决定了元素种类.质子数与中子数之和决定了该元素的相对原子质量.最外层电子数跟元素的性质特别是化学性质密切相关. (6)离子化合物与共价化合物 这是在学习了原子核外电子排布的初步知识后.研究不同元素的原子是怎样形成化合物时.引出的两个概念. 由阴.阳离子相互作用而形成的化合物叫离子化合物.典型的金属元素与典型的非金属元素形成的化合物都是离子型化合物.如KCl.MgCl2.NaF.Na2S等.以共用电子对形成分子的化合物叫做共价化合物.一般两种非金属元素之间形成的化合物都是共价化合物.如H2O.HCl.NH3.CH4等. (7)化合价 化合价是元素的一种性质.一种元素一定数目的原子跟其它元素一定数目的原子相化合的性质.叫做这种元素的化合价.这种性质只有在元素形成化合物时才能表现出来.所以单质中元素的化合价为零. 在离子化合物里.元素化合价的数值等于该元素一个原子得到或失去电子的数目.得电子为负价.失电子为正价.在共价化合物里.元素化合价的数值是该元素一个原子跟其它元素的原子形成共用电子对的数目.电子对偏向的元素为负价.电子对偏离的元素为正价. 任何化合物中各种元素的正负价的代数和为零.根据这一原则.可以依据元素化合价书写化学式.也可以判断化学式书写得是否正确.还能利用化学式.求化合物中某一元素的化合价. 要记住常见元素的化合价.如氢元素一般为+1价.氧元素为-2价.
网址:http://m.1010jiajiao.com/timu3_id_103040[举报]
2014年10月22日,第十五届省运会将在我市举行,运动会的前期准备工作正在如火如荼的进行中,许多方面都与化学知识有关.
(1)为了通风透气,主会馆屋顶采用了钢架结构.钢铁在 中容易生锈,因此必须防锈,可以采用合理的措施是 .
(2)运动会期间需要大量的生理盐水(浓度为0.9%),生理盐水的溶质是 ,1000g生理盐水中含溶质的质量为 g;运动员通常往生理盐水中添加适量的葡萄糖(C6H12O6),以及时补充能量,葡萄糖是由 种元素组成的,其中碳元素和氢元素的质量比是 .
(3)游泳池用二氧化氯(ClO2)做消毒剂,该化合物中氯元素的化合价是 价;二氧化氯气体见光易分解成两种单质,该反应的化学方程式为 .
(4)田径比赛开始时,发令枪的枪口冒白烟是由于红磷燃烧产生的,红磷燃烧的化学方程式为 ;比赛场地还配置了大量的干粉灭火器,干粉灭火器灭火原理是 .
(2分)金属在生活中有广泛的应用,没有金属,生活是难以想象的.
(1)从金属元素的原子结构分析,你认为大多数金属易与其他物质发生反应的根本原因是 _________ .
(2)根据你平常的所见所闻及所学的化学知识,写出保护金属资源的方法(写一种即可) _________ .
查看习题详情和答案>>

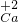 ④2H ⑤Fe ⑥O26种化学符号中,能表示分子的是______(填序号,下同);能表示离子的是______;能表示化合价的是______;能表示金属单质的是______.
④2H ⑤Fe ⑥O26种化学符号中,能表示分子的是______(填序号,下同);能表示离子的是______;能表示化合价的是______;能表示金属单质的是______.