网址:http://m.1010jiajiao.com/timu3_id_102765[举报]
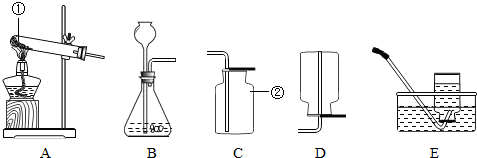
(1)写出指定仪器的名称:①
(2)下面四种途径都可以得到氧气:
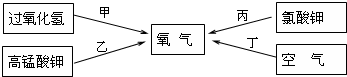
写出实验室中通过甲、乙、丙三种途径制取氧气的文字反应表达式:
甲:
| 二氧化锰 |
| 二氧化锰 |
| 加热 |
| 加热 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
(3)实验室用过氧化氢制取氧气时,可选用的发生装置是
(4)实验室用高锰酸钾制取氧气,实验结束后,发现水槽内的水变成了紫红色,可能的原因是
(5)下面是用高锰酸钾制取氧气的实验步骤:
①加热 ②收集气体 ③检查装置的气密性 ④装入高锰酸钾,并在试管口放一团棉花 ⑤将试管固定在铁架台上 ⑥熄灭酒精灯 ⑦将导管移出水面正确的顺序为
(6)要得到较纯的氧气,用
(7)如果用如图所示装置收集氧气,气体应从
(8)何洁同学在制取氧气过程中,她收集一瓶氧气后,用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃.其原因可能是
(9)工业上制氧气与实验室制氧气在原理上有什么本质区别?
(10)实验室常用醋酸钠固体与碱石灰固体共热来制取甲烷.甲烷常温下是一种无色、无味的气体,密度比空气小.极难溶于水的气体,现选择合适的装置来制取并收集,应该选择的发生装置是

根据以上内容回答1-8小题:
(1)“长征2号F”型运载火箭在升空时发生的下列变化属于化学变化的是
A.火箭点火 B.导流槽内的水受热汽化 C.隔热材料脱落 D.整流罩脱落
(2)“神州七号”太空舱利用NiFe2O4将航天员呼出的废气转化为航天员需要的气体,而NiFe2O4的质量和化学性质都不变化,在该过程中NiFe2O4是
A.反应物 B.生成物 C.催化剂 D.消毒剂
(3)航天员专用的小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点.航天员一次饮用125mL小分子团水,可维持人体6h正常需水量.下列关于小分子团水的说法中正确的是
A.水分子的化学性质被改变了 B.小分子团水中水分子间没有间隙
C.小分子团水中水分子停止了运动 D.小分子团水的部分物理性质与普通水有所不同
(4)神舟七号飞船返回舱在返回地面时会和空气剧烈摩擦产生2000℃以上的高温,为了保证宇航员的生命安全,返回舱的舱壁必须具有
A.耐高温 B.能阻燃 C.隔热
(5)宇航员舱外服实际上是个独立的狭小空间,废气处理系统保障着宇航员的生命.第一步让呼吸产生的废气进入一个装有活性炭的滤网除去臭气,这一过程利用了活性炭的
(6)下一步我国的目标是登陆月球.月球是从哪里来的?千百年来一直困扰着人们.现在关于月球的起源有许多假说,其中最具有影响之一的是“同源说”,意为地球与月球是同一来源.当宇航员脚踏月面,全面分析月壤成分时,这一问题定会迎刃而解了.下列说法支持“同源说”的是
A、月球上也有火山存在 B、月球是围绕地球转动的卫星
C、月球与地球一样含有种类繁多的化合物
D、月球所含的元素种类和质量分数与地球相近
(7)最近科学家经过确认,存在一种化学式为N5的分子,这一发现可能开辟世界能源的新领域,它可能成为我国未来发射火箭的一种新型燃料,下列关于N5的说法正确的是
A.N5是一种化合物 B.N5分子是由氮元素组成的
C.N5中氮元素显零价 D.N5这种物质是由5个氮原子构成的.
| 小麦 | 大米 | 玉米 | 红薯 | |
| 蛋白质(g) | 9.4 | 7.7 | 4 | 1.1 |
| 糖类(g) | 75 | 76.8 | 40.2 | 23.1 |
| 油脂(g) | 1.4 | 0.6 | 2.3 | 0.2 |
| 维生素A(μg) | 11 | 0 | 63 | 125 |
| 维生素C(mg) | 0 | 8 | 10 | 26 |
| 钙(mg) | 25 | 11 | 1 | 23 |
| 铁(mg) | 0.6 | 1.1 | 1.5 | 0.5 |
| 锌(mg) | 0.2 | 0.9 | 0.9 | 0.15 |
(2)中国人的饮食以小麦和大米为主,根据上表分析,应适当补充富含油脂、
(3)下列有关营养素的说法中,不正确的是(
①缺蛋白质,会引起低血糖 ②缺乏维生素C,会引起坏血病
③缺乏铁元素,会引起贫血 ④维生素和无机盐的摄入,应该多多益善
(4)食品安全与健康密切相关.下列做法不会危及人体健康的是(
A.用“苏丹红一号”作食品添加剂 B.蒸馒头时加入适量纯碱
C.加过量亚硝酸钠以保持肉质鲜美 D.用聚乙烯塑料包装食品
(5)油炸食物不宜多吃,因长时间煎炸会产生有毒物质丙烯醛(C3H40),丙烯醛在空气中完全燃烧时,生成二氧化碳和水.请写出丙烯醛完全燃烧的化学方程式

【提出问题】“暖宝宝”为什么能发热?
【做出猜想】“暖宝宝”发出的热量主要来自铁粉氧化(即生锈)的过程.
【设计实验】
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,A袋按使用说明打开外袋取出内袋;B袋不打开外袋.将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度没有明显变化. | “暖宝宝”发热是由于袋内物质与 氧气 氧气 接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于甲、乙两支试管中,分别加入足量稀盐酸,充分反应后静置片刻 | 甲中溶液变黄色; 乙中观察到的现象是 部分溶解,产生无色气泡,(溶液为浅绿色) 部分溶解,产生无色气泡,(溶液为浅绿色) . |
24小时后,A袋内物质中一定含有 氧化铁 氧化铁 . |
| 【得出结论】“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||

(1)将A中的固体溶于水,过滤,将滤渣洗涤、干燥.该步骤的目的是
(2)计算10.0g滤渣中活性炭的质量(列出计算过程).
结论:该“暖宝宝”中的Fe粉和活性炭质量之比为
【后续探究】“暖宝宝”中的氯化钠起什么作用呢?为此同学们做了如下实验:
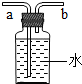
按图2所示装配成A、B、C、D四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
| 时间/小时升时上时高升时度高升时装置高升时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
(2)你认为“暖宝宝”中的氯化钠起的作用是:
追踪科学家的足迹
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标。下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4CI晶体,过滤,得到NH4CI。
材料2:四种盐在不同温度下的溶解度表。
|
盐 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4CI | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
试回答下列问题:
(1)在实验室中,你选择的制备C02反应的化学方程式为 。在工业生产中,要获得生产纯碱的原料CO2 你认为最经济实用的方法是以 为原料,该反应的化学方程式为 。
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是 。
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是 。
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同。) 。在③中,将析出的晶体过滤后,溶液中数量减少的离子有 ;滤液中仍然存在的离子有 。②中反应的化学方程式为 。
(5)在20 ℃时,向含NH4HC03 21 g的饱和溶液中加入足量食盆。试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH4HC03: 79; NaCl: 58.5; NaHC03: 84-, NH4CI: 53.5)。
查看习题详情和答案>> 温度
温度