网址:http://m.1010jiajiao.com/timu3_id_102321[举报]
 为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠; 反应过程中不考虑水和氯化氢的挥发.
[设计方案]
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
[进行实验]
甲组同学:称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00g样品,加入足量的稀盐酸直到反应停止,共收集到4.40g二氧化碳.
[解决问题]请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(计算结果精确到0.1% )
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取18.45g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.90 | 97.80 | 116.70 | 135.60 | 155.05 | 175.05 | 195.05 |
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;
反应过程中不考虑水和氯化氢的挥发。
[设计方案]
(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
[进行实验]
甲组同学:称取12.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀10.00g。
乙组同学:称取12.00g样品,加入足量的稀盐酸直到反应停止,共收集到4.40g二氧化碳。
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(计算结果精确到0.1% )
解:_______________________________________________
答:_______________________________________________
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质________(填一种具体物质)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可。
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取18.45g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.90 | 97.80 | 116.70 | 135.60 | 155.05 | 175.05 | 195.05 |
分析表中实验数据的变化规律,获取反应生成气体的质量,通过有关计算,即可求出稀盐酸的溶质质量分数。
问题:请你在右边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线。

方案I:①称取石灰石样品10g②高温煅烧至质量不再改变,然后把剩余固体放在密闭干燥的容器中冷却至室温,称得剩余固体质量为6.04g.
方案Ⅱ:①称取石灰石样品10g ②加入足量的质量分数为10%的稀盐酸100g,使碳酸钙完全溶解 ③过滤后在滤液中加入过量的质量分数为15%的碳酸钠溶液150g④将步骤③中的沉淀过滤、洗涤、干燥,称得沉淀质量为9g.
方案Ⅲ:①称取石灰石样品lO g②加入足量的稀盐酸,使碳酸钙全部溶解
③用导管将生成的气体通入澄清石灰水(过量) ④将步骤③中生成的沉淀过滤、洗涤、干燥,称得沉淀质量为8.8g.
根据上述回答问题:
(1)在方案I中冷却剩余固体为什么要在密闭干燥的容器中进行?
(2)某同学根据方案I计算碳酸钙的质量分数过程如下:设石灰石中碳酸钙的质量为X,则
CaCO3
| ||
100 56
x 6.04g
| 100 |
| x |
| 56 |
| 6.04g |
CaCO3%=
| 10.78 |
| 10 |
以上解法得出碳酸钙的质量分数超过100%,造成计算结果错误的原因是
(3)方案Ⅱ中求碳酸钙的质量分数时,下列数据不需要的是
A.10%、100g B.10g C.15%、150g D.9g
(4)通过对三个方案中的碳酸钙质量分数的计算可知,方案Ⅲ计算得出的碳酸钙质量分数要比方案工和方案Ⅱ低,你认为其中可能的原因是下面的
A.生成的二氧化碳有部分溶于水 B.导管中仍有部分二氧化碳未排出.
C.生成的沉淀不应该洗涤和干燥 D.稀盐酸不应加足量
(5)请你另外设计一个实验方案,测定石灰石中碳酸钙的质量分数.(提示:可以从求杂质的角度来分析)
上述流程中,沉淀池中发生的主要化学反应为CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
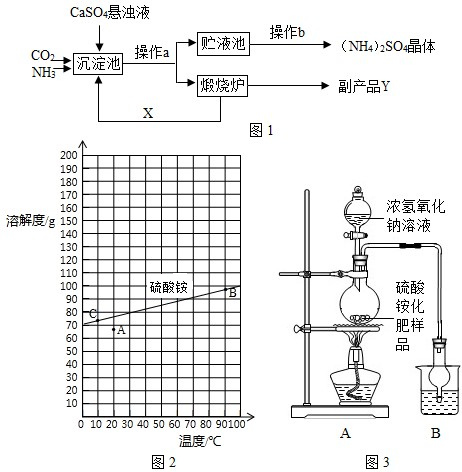
【讨论交流】
(1)操作a的名称是
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为
| ||
| ||
(3)图中操作b应怎样进行呢?
查阅资料:图2是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;
②图中的A点表示硫酸铵溶液的状态不饱和
③若将A点变成B点的操作采用加热蒸发,使溶液浓缩的方法
④若将B点转化为C点时,采用的是冷却热饱和溶液方法
【拓展研究】该化肥厂生产的硫酸铵化肥品质怎样呢?
【查阅资料】下表是硫酸铵化肥品质的主要指标.
| 指标 项目 |
优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶, 无可见机械杂质 |
无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
已知:(NH4)2SO4+2NaOH═Na2SO4+2NH3↑+2H2O
【观察外形】该硫酸铵化肥无可见机械杂质.
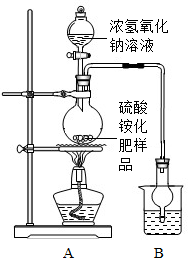
【试验探究】按图3所示装置进行实验)
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)烧杯中盛放的试剂稀硫酸可以吸收氨气,两者化合生成一种
盐,写出化学方程式
【定量研究】取68g硫酸铵化肥样品于烧瓶中,等充分反应后,盛放稀硫酸的烧杯中增重17g,通过计算推知硫酸铵化肥品质指标为
【交流讨论】甲同学认为:应在实验装置A、B之间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能
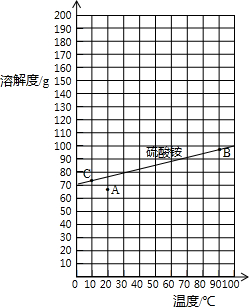
[工艺流程示意图]
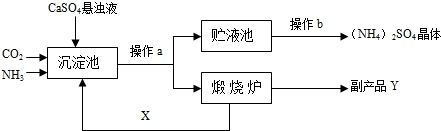
上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
下列说法正确的有
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
已知:(NH4)2SO4+2NaOH
| ||
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因
[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是:
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级.