海南省国兴中学、海师附中、农垦中学、三亚一中
2009年高三联考化学科试题卷副卷
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第I卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。写在本试卷上无效。
3.回答第II卷时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H
第I卷
一、选择题:本题共12小题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。

 1.下列各项表达式正确的是
1.下列各项表达式正确的是
A.O2-的结构示意图: B.Na2S的电子式:
C.乙烯的结构简式:C2H4 D.氮分子的结构式:
2.物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A.①②③⑤ B.①②⑤ C.②⑤⑥ D.①④⑤⑥
3.从下列事实所得出的相应结论正确的是
实验事实
结论
①
SO2的水溶液可以导电
SO2是电解质
②
将燃烧的镁条放入CO2中能继续燃烧
还原性:Mg>C
③
常温下白磷可自燃而氮气须在放电时才与氧气反应
非金属性:P>N
④
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
该溶液中一定有NH4+
A.③④ B.②④ C.①② D.全部
4.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的
B.标准状况下,
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.
5.下列叙述正确的是
A.
B.0.1mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质
C.给pH=12的NaOH溶液通电一段时间后溶液的pH > 12
D.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
6..2008年夏季奥运会将在我国举行。奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KC1O3+6P 3P2O5+5KC1。下列有关该反应的叙述中,正确的是
A.反应中红磷是氧化剂
B.反应中消耗3molP时,转移电子的物质的量为15mol
C.“火药”中的红磷可以用白磷代替
D.发令时产生的白烟只是KC1固体颗粒
7.可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是
A.银氨溶液 B.新制氢氧化铜悬浊液 C.石蕊试液 D.碳酸钠溶液
8.下列溶液中,各组离子一定能够大量共存的是
A.无色溶液中:K+、H+、SO32-、MnO4-
B. 的溶液中:K+、Na+、CO32-、AIO2-
的溶液中:K+、Na+、CO32-、AIO2-
C.能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-
9.某些化学键键能数据如下:
化学键
H―H
C1―Cl
H―Cl
键能
436
243
431
则下列热化学方程式不正确
A. H2(g)+
H2(g)+  Cl2(g)
Cl2(g) HCl(g);
HCl(g); = -91.5
= -91.5
B. H2(g)+ Cl2(g) 2HCl(g);
2HCl(g); = -183
= -183
C. H2(g)+
H2(g)+  Cl2(g)
Cl2(g) HCl(g);
HCl(g); = +91.5
= +91.5
D.2HCl(g) H2(g)+ Cl2(g);
H2(g)+ Cl2(g); = +183
= +183
10.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-===BaSO4↓+NH3?H2O+ H2O
B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C.钠与水反应:Na+2H2O===Na++2OH-+H2↑
D.碳酸钡中加入稀硫酸:BaCO3+2H+===Ba2++CO2↑+H2O
 11.用铅蓄电池电解苦卤水
(含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中正确的是
11.用铅蓄电池电解苦卤水
(含C1-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中正确的是
A.铅蓄电池放电时,溶液的PH值变小
B.铅蓄电池负极的反应式为:Pb ―2e-+SO42― = PbSO4
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a 电极首先放电的是 H+
12.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-)
B.0.1mol?L-1的NaHCO3溶液中:c(Na+)
= c(HCO3-) + c(H2CO3)+
C.0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
第Ⅱ卷
本卷包括必考题和选考题两部分。第13题~第17题为必考题,每个试题考生都必须做答。第18题~第29题为选考题,考生根据要求做答。
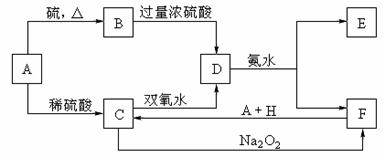
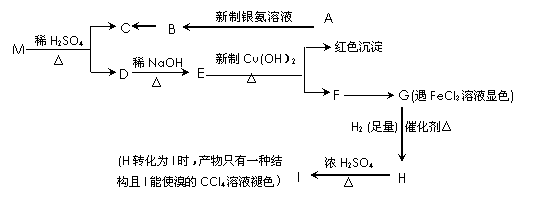
 13.(8分)已知A、B、D、E均为中学化学常见单质或化合物,它
13.(8分)已知A、B、D、E均为中学化学常见单质或化合物,它
们之间的关系如图所示(部分产物略去)。
⑴若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
① B属于 分子(填“极性”或“非极性”),电子式为 ;
②
⑵若A为第三周期中的元素所形成的氯化物。
① 写出A溶液→B的离子方程式 ;
② 写出A和B的溶液反应的离子方程式
14.(10分)中学化学中几种常见物质的转化关系如下:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
⑴红褐色胶体E粒子直径大小的范围: 。
⑵A、B、H的化学式:A ,B ,H 。
⑶①H2O2分子的电子式
②写出C的酸性溶液与双氧水反应的离子方程式: 。
⑷写出鉴定E中阳离子的实验方法和现象: 。
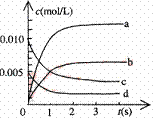
15.(8分) 在 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.01.
0.008
0.007
0.007
0.007
⑴写出该反应的平衡常数表达式:K= 。
|
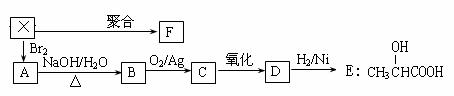
 20.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
20.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
 24.某有机物(名称乙烯酮)的结构简式为:CH2=C=O,下列描述正确的是
24.某有机物(名称乙烯酮)的结构简式为:CH2=C=O,下列描述正确的是 ⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)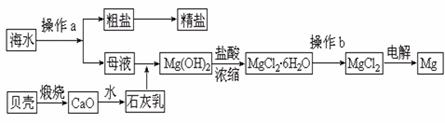
 H(1分)
H(1分) Br2CH― ―OOCCH3 ; 2分
Br2CH― ―OOCCH3 ; 2分 Mg(OH)Cl + HCl↑+5H2O(1分)
Mg(OH)Cl + HCl↑+5H2O(1分)