2008年天津市十二区县重点学校高三毕业班联考(一)
理科综合能力测试
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共300分,考试时间150分钟。第Ⅰ卷1至6页,第Ⅱ卷7至16页。考试结束后,将II卷和答题卡一并交回。
第I卷(选择题,共126分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.选出答案后,用铅笔把答题卡上对应的题目的答案标号涂黑,如需改动,用橡皮擦干净后,再填涂其它答案,不能答在试卷上。
以下数据可供解题时参考:
相对原子质量:H 1 O 16 P 31 Si 28 Cl 35.5 N
一.选择题(本题共21个小题,每小题6分,共126分。在每小题给出的四个选项中,有1个是正确的)
1.下面有关生物实验的叙述中,说法正确的是
①在探究温度对淀粉酶活性影响的实验中,可以使用斐林试剂作为检验试剂
②制作的小生态瓶除了提供必要的成分外,还应是密闭、透明的装置
③用纸层析法分离叶绿体中色素的结果中,蓝绿色色素带位于滤纸条的最下方
④DNA的粗提取实验中,向鸡血细胞液中加蒸馏水的目的是为了使其吸水破裂
⑤用高倍显微镜观察细胞质流动时可以选择液泡作为标志物
A.③⑤ B. ②④ C.①②④ D.①②③
2.右图是一个生态系统主要成分示意图,下列相关叙述正确的是
 A.图中由捕食关系而形成的食物链共有四个营养级
A.图中由捕食关系而形成的食物链共有四个营养级
B.CO2、N2、SO2可以被草直接利用
C.该生态系统中的细菌的代谢类型均为异养需氧型
D.兔和细菌所获得的能量的总和小于草所固定的太阳能
3.生命科学是当代科学的前沿,生物工程的发展正极大地改变着我们的生活,下列关于生物工程的相关叙述不正确的是
A.根据碱基互补配对原则可知,在基因工程中,人工合成的目的基因与用“鸟枪法”获得的目的基因的核苷酸序列应是一样的
B.单克隆抗体制备中两次筛选,第一次筛选出杂交瘤细胞,第二次筛选出能产生相应抗体的杂交瘤细胞
C.人工种子的制作需经历脱分化、再分化的过程
D.通过发酵工程既可以得到多种抗生素、维生素等,也能得到单细胞蛋白
4.下图为人体体液免疫示意图,据图分析有关叙述正确的是

A.把效应B细胞进行细胞培养可以得到细胞系,继而可以得到单克隆抗体
B.机体再次受到同种抗原刺激可在短时间内发生③反应,⑤过程主要发生在内环境中
C.流感病毒侵入人体经⑤过程失去侵染和破坏宿主细胞的能力后,被吞噬细胞彻底水解,可以得到多种氨基酸,一种五碳糖,四种碱基和磷酸
D.①②过程都需要细胞膜上糖被的参与,人体正常细胞癌变后因其细胞膜通透性改变而成为抗原
5.下列对生命活动调节的有关叙述正确的是
A.性行为是以性激素为生理基础的行为,因而动物性行为主要靠性激素调节
B.某人由温暖的室内来到寒冷的室外时,其皮肤血管血流量及肾上腺素的分泌量增加
C.生产中,可以用一定浓度的生长素类似物来挽回向日葵因无法传粉而造成的减产
D.高等动物的神经调节和微生物的酶活性调节都具有快速和精细的特点
6.下列对图形的叙述不正确的是

A. 甲图所示结果可能是基因重组所致
B. 乙图表明,种群中具有抗药基因害虫比例B点比A点高
C.丙图中若A为连续培养装置中青霉菌的生长曲线,则B为该群体青霉素的产量曲线
D.丁图表示生物的受精作用和个体发育过程
7.下面几位同学自己总结出的结论中不正确的是
A.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
B.式量比空气(29)小的气体不可以使用向上排空气法收集
C.有些化学反应可以不属于化合、分解、置换、复分解中的任何一种反应类型
D.原子晶体的熔点不一定都比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
8.下列叙述正确的是
A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:
c(Na+)> c(CHCOO-)> c(H+)= c(OH-)
B.0.1 mol/L KHS的溶液中,c(K+)=
C.
前者小于后者
D.中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等
9.下列说法正确的是
①标准状况下,
②标准状况下,aL的氧气和氮气的混合物含有的分子数约为 ×6.02×1023
×6.02×1023
③
④
⑤1mol乙醇中含有的共价键数约为7×6.02×1023
⑥500mL 1 mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5×6.02×1023
A.①④ B.②⑥ C.③⑤ D.②⑤
10.下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
11.将 4 mol A 气体和 2 mol B 气体在

C的浓度为0.6 mol?L-1 ,下列说法中正确的是
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol?L-1?S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
12.只靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为
 LaNi5H6 +
6NiO(OH)
LaNi5 + 6Ni(OH)2 ,下列说法正确的是
LaNi5H6 +
6NiO(OH)
LaNi5 + 6Ni(OH)2 ,下列说法正确的是
A.放电时储氢合金作正极 B.充电时阳极周围c(OH-)增大
C.充电时储氢合金作阳极 D.放电时负极反应:LaNi5H6+6OH??6e-=LaNi5+6H2O
13.现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超过它们。下列说法正确的是
A.形成气态氢化物的热稳定性由强至弱的顺序是C>D>B
B.在五种元素中,形成的最高价含氧酸的氧化性最强的是E
C.在五种元素形成的常见单质中,l mol单质含共价键的物质的量最多的是B
D.从给定的元素中选出若干种组成的离子化合物中,摩尔质量最小的等于
14、下列说法错误的是:
A.放射性元素的半衰期指大量的放射性元素的原子核有一半发生衰变所需要的时间
B.胃镜利用了光的全反射原理
C.β衰变中的β粒子来源于原子的核外电子
D.无色肥皂液吹出的肥皂泡在阳光的照射下呈现彩色是由于发生了薄膜干涉
15、一束复色可见光射到置于空气中的平板玻璃上,穿过玻璃后从下表面射出,变为a、b两束平行单色光,如图所示,对于a、b两束单色光来说,下列说法正确的是:
 A.a光的波动性比b光的波动性弱
A.a光的波动性比b光的波动性弱
B.两种光照射同一种金属,b光更容易使金属发生光电效应
C.a光光子的能量小于b光光子的能量
D.用同样装置做光的双缝干涉实验,a光比b光得到的干涉条 纹间距大
16、对于一定量的气体,下列说法正确的是:
①外界对气体做功,气体的内能一定增大
②布朗运动是指悬浮在液体中的固体小颗粒的无规则运动
③气体的温度越低,气体分子无规则运动的平均动能越大
④质量一定的气体,压强不变时,温度越高,单位体积内分子个数越少
A.①③ B.②③ C.①④ D.②④
17、下列是某同学对电场中的概念、公式的理解,其中错误的是:
A.根据电场强度的定义式 ,电场中某点的电场强度和试探电荷
,电场中某点的电场强度和试探电荷 的电量无关
的电量无关
B.根据电容的定义式 ,电容器极板上的电荷量每增加1
,电容器极板上的电荷量每增加1 ,电压就增加1
,电压就增加1
C.根据电场力做功的计算式 ,一个电子在1
,一个电子在1 电压下加速,电场力做功为1
电压下加速,电场力做功为1
D.根据电势差的定义式 ,带电量为1
,带电量为1 正电荷,从
正电荷,从 点移动到
点移动到 点克服电场力做功为1
点克服电场力做功为1 ,
, 、
、 点的电势差为-1
点的电势差为-1 。
。
 18、一单相交流发电机的输出电压和时间的关系图线如图所示,则下列说法中错误的是:
18、一单相交流发电机的输出电压和时间的关系图线如图所示,则下列说法中错误的是:
A.发电机的转速为3000r/min
B.交流电压的有效值为220V
C.在0.01s时穿过发电机线圈的磁通量最大
D.若将此交流电接在匝数比为1 0:1的变压器的原线圈上,则接在副线圈两端的交流电压表的示数为22V
19、我国于2007年10月发射了绕月运行的探月卫星“嫦娥1号”。假设该卫星的轨道是圆形的,且贴近月球表面。已知月球的质量约为地球质量的,月球的半径约为地球半径的,地球上的第一宇宙速度约为
 20、顶端装有滑轮的粗糙斜面固定在地面上,A、B两物体通过细绳如图连接,并处于静止状态(不计绳的质量和绳与滑轮间的摩擦)。现用水平力F作用于悬挂的物体B上,使其缓慢拉动一小角度,发现A物体仍然静止。则此过程中正确的选项是:
20、顶端装有滑轮的粗糙斜面固定在地面上,A、B两物体通过细绳如图连接,并处于静止状态(不计绳的质量和绳与滑轮间的摩擦)。现用水平力F作用于悬挂的物体B上,使其缓慢拉动一小角度,发现A物体仍然静止。则此过程中正确的选项是:
A.水平力F变大
B.物体A所受斜面给的摩擦力变大
C.物体A所受斜面给的作用力不变
D.细绳对物体A的拉力不变
 21、如右图所示,一轻质弹簧与质量为m的物体组成弹簧振子,在竖直方向的A、B的两点间做简谐运动,O为平衡位置,振子的周期为T,某一时刻物体正经过C点向上运动已知C点在平衡位置上方h处,从此时刻开始的半个周期内,下列说法错误的是:
21、如右图所示,一轻质弹簧与质量为m的物体组成弹簧振子,在竖直方向的A、B的两点间做简谐运动,O为平衡位置,振子的周期为T,某一时刻物体正经过C点向上运动已知C点在平衡位置上方h处,从此时刻开始的半个周期内,下列说法错误的是:
A.重力对物体做功2mgh B.重力对物体的冲量大小为mgT/2
C.振子所受的回复力的冲量为零
D.振子所受的回复力做功为零
2008年天津市十二区县重点学校高三毕业班联考(一)
理科综合能力测试
第Ⅱ卷 (非选择题,共174分)
注意事项:
1.第Ⅱ卷共10页,用蓝、黑色的钢笔或圆珠笔直接答在试卷中。
2.答卷前,请将密封线内的项目填写清楚。
题号
22
23
24
25
26
27
28
29
30
31
得分
合计
物理
化学
生物
得分
评卷人
二.非选择题:本大题共10小题,共174分.把答案填在答题卷中相应的位置上.
 22、实验题(本题共3小题,共16分,把答案填在题中的横线上或按题目的要求作答)
22、实验题(本题共3小题,共16分,把答案填在题中的横线上或按题目的要求作答)
(1)在测定玻璃折射率的实验中,根据测得的入射角和折射角的正弦值,画出了如图所示的图线,由图可知该玻璃的折射率n= ;当光线由该玻璃射入真空中时,临界角C= 。(用反三角函数表示)
(2)在探究平抛运动的规律时,可以选用下列各种装置图,以下操作合理的是 ( )

A.选用装置1研究平抛物体竖直分运动,应该用眼睛看A、B两球是否同时落地
B.选用装置2要获得稳定的细水柱要显示的平抛轨迹,竖直管上端A一定要低于水面
C.选用装置3要获得钢球的平抛轨迹,每次不一定要从斜槽上同一位置由静止释放
D.除上述装置外,也能用数码照相机拍摄钢球做平抛运动时每秒15帧的录像获得平抛轨迹
(3)在“测定金属电阻率”的实验中,用螺旋测微器测量金属丝的直径,结果如图所示,其读数为 mm;某小组两名同学采用“伏安法”测金属丝的电阻实验中,根据同一组实验数据进行正确描点后,甲、乙两同学根据自己的理解各做出一条图线,如图甲、乙所示。根据你对该实验的理解,你认为 同学的图线正确,根据你选择的图线算出该金属丝电阻
为 Ω(结果保留2位有效数字)。


|

 (2)小球到达半圆轨道起点B之前,轨道对小球的支持力
(2)小球到达半圆轨道起点B之前,轨道对小球的支持力 和刚通过
和刚通过 的比值(
的比值( )。
)。 24、(18分)MN为中间接有电阻R=5Ω的U型足够长金属框架,框架宽度d=
24、(18分)MN为中间接有电阻R=5Ω的U型足够长金属框架,框架宽度d= 25、(22分)如图所示,真空室内,在d≤x≤2d的空间中存在着沿+y方向的有界匀强电场,电场强度为E;在-2d≤x≤-d的空间中存在着垂直纸面向里的有界匀强磁场,磁场强度为B。在坐标原点处有一个处于静止状态的钍核
25、(22分)如图所示,真空室内,在d≤x≤2d的空间中存在着沿+y方向的有界匀强电场,电场强度为E;在-2d≤x≤-d的空间中存在着垂直纸面向里的有界匀强磁场,磁场强度为B。在坐标原点处有一个处于静止状态的钍核 ,某时刻该原子核经历一次
,某时刻该原子核经历一次 衰变,沿+x方向射出一质量为m、电荷量为q的
衰变,沿+x方向射出一质量为m、电荷量为q的 )进入左侧的匀强磁场区域,反冲核恰好不从磁场的左边界射出。如果衰变过程中释放的核能全部转化为
)进入左侧的匀强磁场区域,反冲核恰好不从磁场的左边界射出。如果衰变过程中释放的核能全部转化为 轴坐标。
轴坐标。
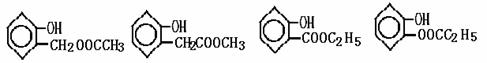
 ,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:




 Ⅲ.菜豆植株地上部分的生长表现出顶端优势,为探究根的生长是否也具有顶端优势(菜豆根为直根系,有主根和侧根之分,如下图所示),某实验小组设计方案如下:
Ⅲ.菜豆植株地上部分的生长表现出顶端优势,为探究根的生长是否也具有顶端优势(菜豆根为直根系,有主根和侧根之分,如下图所示),某实验小组设计方案如下: (每空2分,共4分) (2)BD选对一个得2分,全对得4分,有错误的得0分)(3)1.602―1.605;甲;
(每空2分,共4分) (2)BD选对一个得2分,全对得4分,有错误的得0分)(3)1.602―1.605;甲; (第一个空3分,第二个空2分,第三个空3分,若有效数字错误得2分,共8分)
(第一个空3分,第二个空2分,第三个空3分,若有效数字错误得2分,共8分) ①
①  ② 解得:
② 解得: ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑤
⑤ ⑥ 解得:
⑥ 解得: ⑦
⑦
 ⑧
⑧ ①
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦ 粒子在电场中的运动时间为:
粒子在电场中的运动时间为: ⑧
⑧  ⑨
⑨
 轴方向的位移为:
轴方向的位移为: ⑩
⑩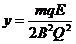
 (1分)
使湿润的红色石蕊试纸变蓝(1分)(其它合理答案均可)
(1分)
使湿润的红色石蕊试纸变蓝(1分)(其它合理答案均可)
 =Fe3++NO↑+2H2O(2分)
=Fe3++NO↑+2H2O(2分) (各2分)
(各2分) +2Cu(OH)2
+2Cu(OH)2
 +Cu2O↓+2H2O
+Cu2O↓+2H2O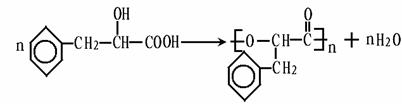
 +CH3CH2OH
+CH3CH2OH
 +H2O
+H2O (2分)
(2分)