高一化学同步测试氧化还原反应
说明:本卷答题时间60分钟,满分100分。
以下数据可供解题时参考:
相对原子质量:H:1 N:14 O:16 Cl:35.5 Mn:55
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.下列化学反应中,不属于四种基本反应类型的是 ( )
A.2FeCl3+Cu=2FeCl2+CuCl2 B.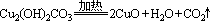
C.4Fe(OH)2+O2+2H2O= 4Fe(OH)3↓ D.CaCO3+2HCl=CaCl2+H2O+CO2↑
2.下列关于氧化还原反应的叙述,正确的是 ( )
A.失去电子的反应是还原反应 B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂 D.作氧化剂的物质不能是还原剂
3.下列基本反应类型中,一定不属于氧化还原反应的是 ( )
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
4.下列反应不属于氧化还原反应的是 ( )
A. 2H2O2 = 2H2O + O2↑; B.CuCl2+2NaOH==Cu(OH)2↓+2NaCl
C.2Na+2H2O=2NaOH+H2↑ D.3CO+Fe2O3 ==2Fe+3CO2
5.某元素在化学反应中,由化合态变为游离态,则该元素 ( )
A.化合价降低为零 B.一定被还原
C.可能被氧化,也可能被还原 D.一定被氧化
6.氢化钙中的氢元素为-1价,它可用作生氢剂,反应的化学方程式是:
CaH2+2H2O=Ca(OH)2+2H2↑ ,在该反应中水的作用是 ( )
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
7.某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合物将 ( )
A.无法确定 B.升高 C.不变 D.降低
8.在3NO2+H2O = 2HNO3+NO↑反应中,氧化剂与还原剂的分子数之比为 ( )
A.2∶1 B.1∶
9.苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明维生素C具有 ( )
A.还原性 B.氧化性 C.碱性 D.酸性
10.已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2+ +Cl2 =2Fe3+ +2Cl-
则有关离子的还原性由强到弱的顺序为 ( )
A.Cl->Fe2+>I- B. Fe2+>I->Cl-
C.I->Fe2+>Cl- D.Fe2+>Cl->I-
二、选择题(本题包括6小题,每小题4分,共24分。在每题给出的四个选项中,有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确给满分,但只要选错一个该小题就为0分)
11.下列有关氧化还原反应的叙述中正确的是 ( )
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原的本质是元素化合价的升降
C.失电子的反应物在反应中作氧化剂,反应中被还原
D.金属单质在化学反应中一定作还原剂
12.下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是 ( )
A.SO2+H2O= H2SO3 B.Cl2+ H2O=HCl+HClO
C.
13.高空大气层中O2吸收紫外线后可变成臭氧(O3),O3可按下式分解:O3 = O2 + O,O3
又和大气污染物NO发生反应,NO + O3 == NO2+ O2 , NO2 + O = NO + O2 ,最后
结果2O3 = 3O2 。从反应过程和最终产物判断NO起的作用是 ( )
A.氧化剂 B.还原剂 C.催化剂 D.中间产物
 14.对于该反应TiCl4+4Na 4NaCl+Ti,下列说法正确的是
( )
14.对于该反应TiCl4+4Na 4NaCl+Ti,下列说法正确的是
( )
A.该反应说明钠是强还原剂,可用来冶炼金属
B.该反应的条件是TiCl4熔融状态或水溶液中
C.Ti是氧化产物
D.若有4个Na原子参加反应,电子的转移数为4e―
15.已知反应3Cl2+6NaOH===5NaCl+NaClO3+3H2O下列说法不正确的是 ( )
A.Cl2既是氧化剂也是还原剂 B.被氧化的氯原子数是被还原的氯原子数的5倍
C.氧化剂和还原剂的质量比是1:5 D.NaCl是还原产物,NaClO3氧化产物
16.在一定条件下发生如下反应:
2KClO3+I2 2KIO3+Cl2,则下列推断正确的是
( )
A.该反应属于置换反应 B.该反应中KClO3被还原为Cl2
C.该反应中还原剂为KClO3 D.该反应中氧化剂为I2
三、填空、简答和计算(共7个小题,总分46分)
17. (6分)在H+、Mg2+ 、Fe2+、Fe3+、S2-、I-、S中,只有氧化性的是____________,只有还原性的是________,既有氧化性又有还原性的是___________。
18.(8分)某化工厂按如下步骤进行生产:①以煤为燃料煅烧石灰石;②用饱和Na2CO3溶液吸收步骤①中产生的CO2 (转化为Na2HCO3);③使步骤①中产生的CaO跟水反应;④消石灰跟Na2CO3溶液反应。
(1)生产过程中没有涉及到的化学反应类型是______________________________
(2)该厂生产过程中涉及的物质有:①煤②纯碱③小苏打(NaHCO3)④烧碱⑤二氧化碳⑥消石灰.下列叙述中正确的是_________
A.起始原料是①② B.起始原料是②⑥
C.最终产品是④⑤ D.最终产品是③④
(3)该厂生产过程的优点可能有__________
①排放的气体对大气无污染. ②生产过程中的部分产品可作为起始原料使用. ③无高温作业
(4)写出④反应的反应方程式_______________________
19.(6分)在KClO3+6 H Cl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是________,试标出反应电子转移方向和数目_________________________
20.(5分)写出符合下列条件的化学方程式:
(1)一种单质还原一种化合物的一种元素:
_____________________________________________.
(2)一种单质氧化一种化合物的一种元素:
_____________________________________________.
(3)同一种物质中,一种元素氧化另一种元素:
_____________________________________________.
(4)一种非金属单质还原一种氧化物
______________________________________________
(5)一种氧化物还原另一种氧化物
______________________________________________
21.(4分)已知过氧化氢(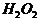 )中氧呈现
)中氧呈现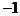 价,试根据氧化还原反应中价态变化的规律,推测
价,试根据氧化还原反应中价态变化的规律,推测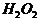 参加的氧化还原反应中的氧化产物和还原产物可能是什么物质?
参加的氧化还原反应中的氧化产物和还原产物可能是什么物质?
__________________________________________________________________
22.(8分)根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。
(1)氧化剂__________,还原剂____________
(2)反应中转移电子数是______
(3)氧化剂与氧化产物的质量比__________
(4)当生成28gN2时,被氧化的物质的质量是__________g。
23.(9分)取含MnO2的软锰矿石
(1)这种软锰矿石中MnO2的百分含量。
(2)被氧化的HCl为的质量。
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
D
B
C
B
C
B
A
C
二、选择题
题号
11
12
13
14
15
16
答案
D
B
BC
AD
BC
AB
三、填空、简答和计算
17.H+、Mg2+、Fe3+;S2-、I-;Fe2+ S。
18.(1)置换反应;(2) AD;(3) ①②
19. KClO3 ,Cl2, 1∶1, 5∶1, 
20.(1)Fe+CuSO ==FeSO
==FeSO +Cu (2)2CO+O
+Cu (2)2CO+O ==2CO
==2CO
(3) 2KClO3 2KCl+3O2↑(4)CuO+ H2
2KCl+3O2↑(4)CuO+ H2 Cu+H2O (5) CuO+ CO
Cu+H2O (5) CuO+ CO  Cu+ CO2
Cu+ CO2
21.氧化产物可能为O2,还原产物可能为H2O.
22. (1)Cl2 ,NH3 (2)6e- (3)213:28 (4)34
23.解:设
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
87 2×36.5 71
m
m1=
MnO2%=
答:这种软锰矿石中MnO2的百分含量为78.1%;被氧化的HCl为