江苏省扬州中学2008~2009年度第二学期期中考试
高一(必修)化学试卷 2009.4
可能用到的相对原子质量:H:
一、选择题(本题包括23小题,每小题3分,共69分,每小题只有一个选项符合题意)
1.“绿色化学”要求从根本上减少乃至杜绝污染。下列对农作物收割后留下的秸杆的处理方法中,不符合“绿色化学”的是
A.就地焚烧 B.发酵后作农家肥 C.加工成精饲料 D.制造沼气
2.同一个原子的下列电子层中,能量最低的是
A.K层 B.L层 C.M层 D.N层
3.下列物质互为同素异型体的是
A.O2与O3 B.
4.下列原子序数所对应的元素组中,两者可形成离子键的是
A.1和17
B.12和
5.下列物质中,熔点最低的是
A.氯化钠 B.金刚石 C.汞 D.硫化氢
6.下列说法中不正确的是
A.在共价化合物中也可能含有离子键
B.非金属元素之间形成的化合物不一定是共价化合物
C.含有共价键的化合物不一定是共价化合物
D.含有离子键的化合物一定是离子化合物
7.下列物质中,不含共价键的是:
A.NaCl B.Cl2 C.HCl D.NaOH
8.下列变化中,不需要破坏化学键的是
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠熔化
9.下列关于化学反应速率的说法正确的是
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率常用单位时间内任何一种反应物物质的量的减小或生成物物质的量的增加来表示
C.可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D.增大反应物的浓度、提高反应温度都能增大反应速率
10.俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义。该原子的中子数是
A. 61 B.
11.元素的性质随着原子序数的递增呈现周期性变化的根本原因是
A.元素相对原子质量的递增,量变引起质变
B.元素的化合价呈周期性的变化
C.元素原子核外电子排布呈周期性的变化
D.元素的金属性和非金属性呈周期性变化
12.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是

 13.一定温度下,可逆反应3X(g)+Y(g)
2Z(g)达到反应限度的标志是
13.一定温度下,可逆反应3X(g)+Y(g)
2Z(g)达到反应限度的标志是
A.单位时间内生成3n mol X,同时消耗n mol Y
B.X的生成速率与Z的生成速率数值相等
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数比为3:1:2
14.下列各图所表示的反应是吸热反应的是
 |
A B C D
15.下列说法正确的是
A.在周期表中金属和非金属的分界处寻找催化剂和耐高温、耐腐蚀的合金材料
B.元素性质随着电子层数的递增而呈周期性的变化叫元素周期律
C.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
D.相对分子质量相同,而结构不同的化合物互称为同分异构体
16.对于A2 + 3B2
A.v(B2) =0.9mol/(L•s); B.v(A2) =0.5mol/(L•s);
C.v(C) =0.62mol/(L•s); D.v(B2) =4.2mol/(L•min)
17.下列关于反应限度的叙述不正确的是
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.不少反应都具有可逆性,只是有的程度小,有得程度大
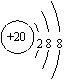 18.下列物质结构与对应的用语表达都正确的是
18.下列物质结构与对应的用语表达都正确的是
A.O-C-O:二氧化碳的结构式 B. : Ar原子的结构示意图
C. :氯化铵的电子式 D.
:氯化铵的电子式 D.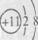 :钠离子的结构示意图
:钠离子的结构示意图
19.随着人们生活质量的不断提高,废旧电池必须进行集中处理的问题被提到政府的议事日程,其主要原因是
A.回收废旧电池中的石墨电极材料
B.防止电池中汞、镉和铅等重金属元素对土壤和水源的污染
C.防止废旧电池中渗漏的电解液腐蚀其他物品
D.回收废旧电池外壳的金属材料
20.已知在
A.
B.
C.
D.
 21.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
21.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
22.甲乙两种非金属:①甲比乙容易与H2化合;②甲的氢化物比乙的氢化物稳定③甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是
A.只要④ B.只有⑤ C.①②③ D.①②③④⑤
23.W、Y、Z为原子序数依次增大的同周期的短周期元素。已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
A.W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸
B.Z元素在第三周期第VIA族
C.W、Y、Z三种元素有两种是金属,一种是非金属
D.Y、Z最高价氧化物对应的水化物间反应的离子方程式:H++OH-=H2O
二、填空题(本题包含4小题,共21 分)
24.(4分)用铜片、锌片和稀硫酸及若干其他器材组合成一个原电池,
写出该电池的负极反应式: 发生 反应,
正极反应式为: 发生 反应。
25.(6分)( 1 )下列7种物质:A. P4(白磷), B.SiO2, C.NH4Cl,D.Ca(OH)2,E.NaF,
F.CO2, G.金刚石 ,固态下都为晶体,回答下列问题:(填写化学式)
① 熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是
② 晶体中既有离子键又有共价键的是 ;
③ 熔点最高的晶体是
( 2 ).某元素最高正化合价为+6,其最低负价为________。某元素R与氢形成的气态氢化 物的化学式为RH3,其最高价氧化物的化学式为____________。
26.(6分)用元素符号或化学式回答原子序数11~17的元素的有关问题:
(1)原子半径最大的元素是 ;
(2)单质晶体属于原子晶体的是______ __;
(3)最高价氧化物对应水化物呈两性元素的是 ;
(4)最高正价氧化物对应水化物酸性最强的酸是 ;
(5)最高价氧化物对应水化物碱性最强的碱是 ;
(6)最高正价与负价绝对值相等的元素的氢化物是 ;
27.(5分)在下列事实中,什么因素影响了化学反应的速率?
⑴黄铁矿煅烧时要粉碎成细小颗粒
⑵夏天的食品易变质,在冬天不易发生该现象
⑶同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体锌比镁慢
⑷同样大小的石灰石分别在0.1 mol?L-1的盐酸和1 mol?L-1的盐酸中反应速度不同
⑸H2O2分解放出气泡很慢,撒入少量MnO2产生气体很快 。
三、计算题(本题包括1个小题,共10分)
28.(10分)把0.4 mol X气体和0.6 mol Y气体混合于
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
命题、校对:张霞

江苏省扬州中学2008~2009年度第二学期期中考试
高 一(必修)化学答题纸
二、填空题
24.(4分)____________________________ _____________
_________________________________ ______________
25. (6分) ⑴ ①____________ ____________
②____________ ③ ____________
(2)_________________ _、_______________________
26.(6分) ⑴_______________ ⑵________________ ⑶______________ (4)_______________ (5)_________________ (6)_______________
27.(5分) ⑴_______________ ⑵________________ ⑶_________________ (4)_______________ (5)_________________
三、计算题
28. (10分)
一、选择题(每小题只有1个正确选项,共69分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
A
A
B
D
A
A
C
D
C
C
A
题号
13
14
15
16
17
18
19
20
21
22
23
答案
A
A
C
B
A
D
B
B
C
C
C
二、填空题
24.Zn-2e-=Zn2+ (1分) 氧化(1分) 2H++2e-=H2↑(1分) 还原(1分)
25. (1)P4 CO2 ; SiO
26. (1)Na(2) Si (3) Al(4)HclO4(5)NaOH(6)SiH4
27. ⑴反应物的接触面积 ⑵反应温度 ⑶反应物的本性 ⑷反应物的浓度 ⑸催化剂
28.(1)0.05 mol?(L?min)-1 (4分);(2)0.175 mol?L-1 (4分)(3)n=4 (2分)