玉田一中2008--2009第一学期12月份高三阶段考试
化 学 试 卷
本试卷分第I卷和第II卷两部分,全卷满分110分。考试时间90分钟。
可能用到的原子量: H
Cl-35.5 K-39 Ca -40 Fe-56 Cu-64 Zn-65
第Ⅰ卷(选择题 共50分)
一、选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意)
1.下列有关叙述正确的是:
A、铜可导电,所以铜是电解质 B、MgCl2在熔融状态下可导电,它是电解质
C、HCl、H2SO4液态时都不导电,都是非电解质 D、能导电的单质一定是金属
2.下列说法可以实现的是:①酸性氧化物均能与水发生反应;②盐溶液与弱酸反应可以生成强酸;③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成;④两种气体在水溶液中生成两种强酸;⑤有单质参加反应,但该反应不是氧化还原反应
A.②③④⑤ B.①③④⑤ C.②③④ D.①②③④⑤
3. 在实验室中,下列试剂的保存方法正确的是
①白磷和液溴都用水来密封保存②碱金属均保存在煤油中③氢氧化钠和氢氟酸溶液均保存在带橡胶塞的玻璃瓶中④氯水和浓硝酸均保存在棕色细口玻璃塞试剂瓶内 ( )
A.①③④ B.③④ C.①④ D.①②③④
4.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是
①F2和H2O ②Na和H2O ③Na2O2和H2O ④NO2和H2O ⑤Na2O和H2O
⑥Cl2和H2O
A.③④⑤⑥ B.①⑤ C.②③⑤ D.③④⑥
5、对下列事实的解释正确的是:
A、在木屑上加入浓硫酸后出现发黑现象,说明浓硫酸具有强氧化性。
B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定。
C、常温下,浓硝酸和浓硫酸可以用铝罐贮存,说明铝与浓硝酸和浓硫酸发生不反应
D、二氧化硫能使溴水褪色,说明二氧化硫具有漂白性。
6.下列各组离子可能大量共存的是
A.pH=1的溶液中:Fe2+、Al3+、HCO3―、SO42―
B.滴加石蕊试剂变红的溶液:K+、NO3―、Cl-、S2-
C.含有大量OH-的无色溶液中:Na+、Cu2+、AlO2―、SiO32―
D.常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、C1-、S2-、SO32―
7.下列叙述正确的是( )
(A)分子晶体中的每个分子内一定含有共价键
(B)原子晶体中的相邻原子间只存在非极性共价键
(C)离子晶体中可能含有共价键
(D)金属晶体的熔点和沸点都很高
8.对下列反应①KHCO3溶液与石灰水反应、②Na2CO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应,⑤NaAlO2与硫酸的反应,⑥过氧化钠与水的反应。改变反应物用量,不能用同一个离子方程式表示的是
A.①②③⑤ B.①②④⑤ C.①③④⑥ D.②③④⑥
|
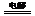 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
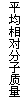
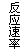
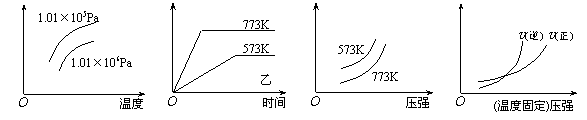
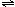 2NH3(g);△H=-Q1 kJ/mol(Q1>0)
2NH3(g);△H=-Q1 kJ/mol(Q1>0)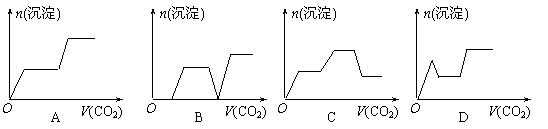

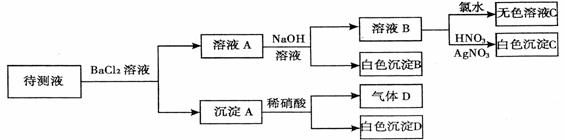
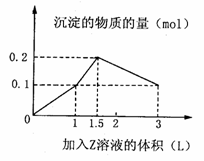 19.某
19.某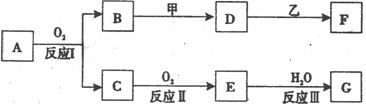
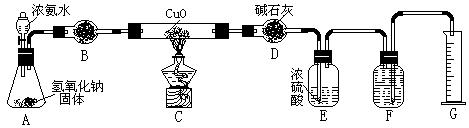
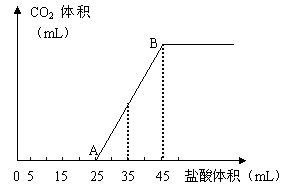 (1)写出OA段所发生反应的离子方程式
(1)写出OA段所发生反应的离子方程式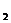 = 2NO
= 2NO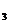 + O
+ O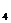

 NH4+
+ H2O NH3?H2O+H+
NH4+
+ H2O NH3?H2O+H+
 3Cu + N2 + 3H2O 。。
3Cu + N2 + 3H2O 。。 x +
y = 1mol/L×(0.045-0.025)L
x +
y = 1mol/L×(0.045-0.025)L