福州高级中学2008-2009学年第一学期期中考试高二化学《物质结构与性质》试卷
命卷教师:庄阳彬 审卷教师:陈立明
试卷总分:100+50分 完卷时间:90分钟
考试时间:90分钟 满分:150分
可能用到的相对原子质量: H-1 C-12 O-16 Na-23 I-127 K-39
一、选择题(每小题只有一个正确答案,每小题3分,共60分)
2.以下符号正确的是 ( )
A.2d1
B.
3.按能量由低到高的顺序排列,正确的一组是 ( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
4.下列基态原子或离子的电子排布式错误的是 ( )
A. K 1s22s22p63s23p64s1 B. Mg2+ 1s22s22p6
C. F- 1s22s22p5 D. Br 1s22s22p63s23p63d104s24p5
5.某元素原子3d轨道上有5个电子,则该原子最外层电子的排布可能是 ( )
A.4s1 B.4s24p1 C.4s24p3 D.3s23p63d5
6.下列说法中正确的是:
A.随原子序数的递增,第三周期元素的电负性逐渐减小
B.铝的第一电离能比镁的第一电离能大
C.在所有的元素中,氟的第一电离能最大
D.在所有的元素中,氟的电负性最大
7. 下列按电负性减小顺序排列的是 ( )
A . K、Na、Li B. As、P、N C. N、O、F D. O、S、Se
8.金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的( )
A.Li Na K B.Na Mg Al C.Li Be Mg D.Li Na Mg
9.某原子核外共有6个电子,分布在K与L电子层上,在下列L层分布中正确的是 A.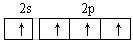 B.
B.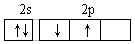
C.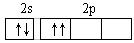 D.
D.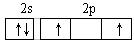
10.下列分子含有的电子数目与HF相同,且只有两个极性共价键的是
A.CO2 B.N2O C.H2O D.CH4
11.既有离子键又有配位键的化合物是 ( )
A.NH4NO3 B.NaOH C.H2SO4 D.H2O
12.金属的下列性质中,与自由电子无关的是()
A.易导热 B.容易导电 C.延展性好 D.密度大小
13.下列叙述正确的是 ( )
A.氯化钠晶体不能导电,所以氯化钠不是电解质
B.氯化钠溶液能导电,所以氯化钠溶液是电解质
C.熔融的氯化钠和氯化钠溶液都能产生自由移动的离子
D.氯化钠熔融时不破坏氯化钠晶体中的离子键。
14.下列性质中,能充分说明某晶体是离子晶体的是 ( )
A.具有较高的熔点 B.固态不导电,水溶液能导电
C.可溶于水 D.固态不导电,熔融状态能导电
15.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是 ( )
A.H2 B.Cl
16.在CsCl晶体中,每个Cs+周围的Cl-个数是
A.6 B. 8 C. 9 D. 11
17.有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN的晶体结构为 ( )
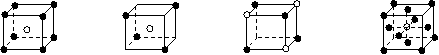 |
A B C D
18.下列大小关系正确的是 ( )
A.熔点:NaI>NaBr B.硬度:MgO>CaO
C.晶格能:NaCl<NaBr D.熔沸点:CO2>NaCl
19.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是 ( )
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HnX
20. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A 的正价与B的负价绝对值一定相等;⑥A的电负性小于B的电负性;⑦A的第一电离能大于B的第一电离能。其中正确的组合是 ( )
A.①②⑦ B.③④⑥ C.③⑤ D.③④⑤⑥⑦
第二卷 共90分
21.(6分)试用电子式表示下列过程
(1)MgCl2 :________________________________________________________________
(2)Br2: ________________________________________________________________
(3)H2O: ________________________________________________________________
22.(10分)用“>”、“<”、“=”填空
(1)第一电离能:P_________S;
(2)酸性:H3PO4 _______ H2SO4;
(3)稳定性:H2O______H2S_______H2Se;
(4)微粒半径:S2-____Cl―______K+;S____S2-
(5)碱性:KOH_________NaOH________Al(OH)3;
(6)元素的电负性:S_____Cl。
23.(8分)组成A、B、C、D分子的元素原子序数均小于10,它们之间能发生如下图所示的反应。其中A的水溶液能使酚酞试夜变红,组成B的元素的电负性在周期表中最大。请写出A、B、C、D的化学式:
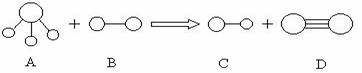
A____________;B____________;C____________;D____________。
24.(16分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,D的最高正价与最低负价的代数和为4,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________, D是________,E是_________。
(2)写出B元素原子的轨道表示式______________________________________。
(3)写出C元素原子的电子排布式_________________________。
(4)E与B、D所形成的化合物的微粒间作用力是____________。
(5)写出A和B形成的化合物的电子式______________________
25.(10分)在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和族序数(A)有如下经验公式:K=A/n (K为A与n的比值)。请选编号回答下列问题:
A.两性金属 B.金属 C.非金属 D.稀有气体
(1)当n一定时,K值越大,则元素的_____________性越强。
(2)当A一定时,K值越小,则元素的________性越强。
(3)当K=0,则该元素系_________元素;
当K=l时,则该元素系_________元素(n≠1);
当K<1时,则该元素系_________元素。
26.(18分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
b
h
j
a
c
f
i
l
m
e
g
d
k
(1)上述元素的单质可能是电的良导体的是______(填字母代号)。
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ?mol-1):
锂
X
Y
第一电离能
519
502
580
第二电离能
7296
4570
1820
第三电离能
11799
6920
2750
第四电离能
9550
11600
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________。
②表中Y可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的电子式是 ________和_________ 。
(3)写出元素e的电子排布式____________________。
(4)以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于________区、__________区
27.(16分)现有部分短周期元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
T
M层上有2对成对电子
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素最高正价是+7价
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
非金属性强弱的判断方法有很多种,请写出另一种判断方法(用化学方程式表示):
_____________________________________________________________
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是_______________ _____ ___ 。

28.(6分)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式:
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为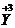 ,
,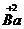 ,
,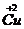 和
和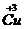 )试计算化合物中这两种价态Cu原子个数比
)试计算化合物中这两种价态Cu原子个数比
福州高级中学2008-2009学年第一学期期中考试
1
2
3
4
5
6
7
8
9
10
B
D
C
C
A
D
D
B
D
C
11
12
13
14
15
16
17
18
19
20
A
D
C
D
D
B
A
B
B
B
21.(1) +
+ +
+ →
→
(2)
(3) +
+ +
+ →
→
22.⑴>;⑵< ⑶>,> ⑷>,>,< ⑸>,> ⑹<
23.A: ; B:F2; C:HF; D:N2
; B:F2; C:HF; D:N2
24.(1)H S K(写元素名称也可)
(2)
|
 (任答一个均可)
(任答一个均可) 。 (2)
。 (2)  。 (3)Cl; b;Cl2+H2S=2HCl+S。 (4)H2CO3; 弱酸性或非氧化性酸(合理即给分)。
。 (3)Cl; b;Cl2+H2S=2HCl+S。 (4)H2CO3; 弱酸性或非氧化性酸(合理即给分)。