2008年11月
绵阳南山中学2008秋季高2010级半期考试化学(文科)试题
命题人:杜红帅
本试卷分卷Ⅰ和卷Ⅱ两部分。卷Ⅰ 为选择题,卷Ⅱ 为非选择题。本试卷共60分。考试时间为60分钟。
第I卷 选择题部分(40分)
一、选择题(共20题,每小题2分)
1.在下列过程中,需要加快化学反应速率的是( )。
A.钢铁腐蚀 B.事物腐败 C.炼钢 D.塑料老化
2.某一反应的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )。
C.0.8mol/(L?S) D.0.O4mol/L
3.在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )。
A.反应开始时。正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
4.在一定条件下,对于密闭容器中进行的反应:P(g) + Q(g)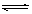 R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是(
)。
R(g) + S(g)。下列说法中可以充分说明这一反应已经达到化学平衡的是(
)。
A.P、Q、R、S的浓度相等 B.P、Q、R、S在密闭容器共存
C.P、Q、R、S的浓度不再变化
D.用P来表示的反应速率与用Q表示的反应速率相等
5.在一定条件下,发生CO + NO2 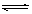 CO2
+ N2的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列说法正确的是( )。
CO2
+ N2的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列说法正确的是( )。
A.正反应为吸热反应堆 B.正反应为放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
6.下列电离方程式中,正确的是
A.NH3.H2O=NH4+ + OH- B.CuCl2 = Cu2+ + Cl-
C.H2CO3=
2H+ + CO32-
D.NaOH = Na+ +
7.下列离子方程式,能正确反应CH3COOH与NaOH反应的是
A.CH3COOH
+
B.
C.CH3COOH
+ Na+ +
D.CH3COO-
+ H+ +
8.在48mL0.1mol/LHNO3溶液中加入12mL 0.4mol/LKOH溶液时,所得到的溶液呈( )。
A.弱酸性 B.强氧化性 C.碱性 D.中性
9.下列物质的水溶液,其pH小于7的是( )
A.Na2CO3 B.NH4Cl C.Na2SO4 D.KNO3
10.物质的量浓度相同的一元强酸与一元强碱相互反应时,溶液( )。
A.呈酸性 B.呈碱性 C.呈中性 D.酸碱性无法判断
11.反应A(s)+B(g)=c(g)在密闭容器中进行,下列情况中,不能使反应速率加快的是 ( )。
A.升高温度 B.增加A的物质的量
C.使用催化剂 D.缩小容器体积使压强增大
12.下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是( )。
A.2NO2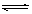 N2O4(正反应为放热反应)
N2O4(正反应为放热反应)
B.3O2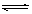 2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
C.H2(g)+I2(g) 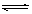 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D.NH4HCO3(s) 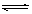 NH3+H2O(g)+CO2(正反应为吸热反应)
NH3+H2O(g)+CO2(正反应为吸热反应)
13.对于达到平衡状态的可逆反应:N2+3H2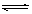 2NH3(正反应为放热反应),下列叙述中正确的是(
)。
2NH3(正反应为放热反应),下列叙述中正确的是(
)。
A.反应物和生成物的浓度相等
B.反应物和生成物的浓度不再发生变化
C.降低温度,平衡混合物里NH3的浓度减小
D.增大压强,不利于氨的合成
14.对于在一密闭容器中进行的下列反应:C(s)+O2(g)=CO2(g),下列说法中错误的是
A.将木炭粉碎成粉末状可以加快化学反应速率( )。
B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率
D.增加木炭的量可以加快化学反应速率
15.下列说法中正确的是( )。
A.可逆反应达到化学平衡时的特征之一是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以增大正反应速率,化学平衡向正反应方向移动
16.0.1mol/L K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1mol/L。如果要使c(CO32-)更接近于0.1mol/L,可以采取的措施是( )。
A、加入少量盐酸
B、加入适量水
C、加入适当KOH D、加热
17、在一定条件下,发生CO + NO2 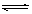 CO2 + NO的反应,正反应为放热,达到化学平衡后,降低温度,,下列有关该反应得说法中正确的是( )
CO2 + NO的反应,正反应为放热,达到化学平衡后,降低温度,,下列有关该反应得说法中正确的是( )
A.向正反应方向移动
B.向逆反应方向移动
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
18、增大压强,对已达到平衡的下列反应产生的影响是 3X(g)+ Y(g) 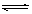 2Z(g) +2Q(s)说法正确的是( )。
2Z(g) +2Q(s)说法正确的是( )。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
19、一元强酸与一元强碱恰好完全中和时,它们起反应的( )一定相等的是。
A.质量 B.物质的量 C. 物质的量浓度 D.体积
20.在一个盛有20mL0.1mol/LNaoH溶液和10 mLH2O的容器中,逐滴加入0.1mol/L HCl溶液,当溶液中的碱溶液恰好被加入的酸溶液中和时,容器内溶液的总体积约是( )。
A.40 mL B.50 mL C.60 mL D.70 mL
第Ⅱ卷 填空题部分(20分)
二、共14分,每小题1分
21、在下列空白处说明反应条件的改变对化学平衡的影响。
条件的改变
对化学平衡的影响
增大反应物的浓度
增大容器中气体的压强
升高温度
适当使用催化剂
22、在某一化学反应中,反应物B的物质的量浓度在5s内从2.0mol/L变成0.5mol/L,在这5s内B的化学反应速为 。
23、在一定条件下,下列反应达到化学平衡:2HI(g)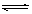 H2 (g)
+ I2 (g)(正反应方向是吸热反应)。
H2 (g)
+ I2 (g)(正反应方向是吸热反应)。
⑴如果升高温度,平衡混合物的颜色 。
⑵如果加入一定量的H2,平衡向 反应方向移动。
⑶如果使密闭容器的体积增大,平衡 移动。
24.在弱电解质的电离过程中,分子电离成离子的速率渐 ,同时离子结合成分子的速率逐渐 ,在一定条件下,当两者的速率 时,就达到了电离平衡状态。
25.一般强酸弱碱生成的盐,其水溶液呈 性;强碱弱酸所生成的盐,其水溶液呈 _______ 性;强酸强碱所生成的盐,其水溶液呈 性。
①NH4NO3 ②CH3COOK
1
2
3
4
5
6
7
8
9
10
C
B
B
C
B
D
A
D
B
D
11
12
13
14
15
16
17
18
19
20
B
B
B
D
A
C
A
C
B
B
21、在下列空白处说明反应条件的改变对化学平衡的影响。
条件的改变
对化学平衡的影响
增大反应物的浓度
正向移动
增大容器中气体的压强
向体积减小方向移动
升高温度
向升高温度方向移动
适当使用催化剂
不移动
22、0.3mol/(L?S)
23、加深 逆向移动 不移动
24、逐渐减小 逐渐增大 相等
25、酸性 碱性 中性