2009届湖南省长沙市长郡中学高三第四次月考
化学试卷
时量:90min 满分:108分
命题:长郡中学高三化学备课组 关中岩
可能用到的相对原子质量:H~1,N~14,O~16,Na~23,S~32,Cl~35.5,
Fe~56,P~31
一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡发生移动的是( )。
A.反应混合物的浓度 B.反应物的转化率
C.正.逆反应速率 D.反应混合物的压强
2.北京2008奥运会金牌直径为
A.硫酸铜溶液 B.氢氧化钠溶液 C.稀硝酸 D.硝酸银溶液
3.下列有关说法正确的是( )
A.合成氨工业与接触法制硫酸中的SO2的催化氧化过程中都采用了高压的生产条件
B.结构陶瓷碳化硼(B
C.制造光缆的主要材料是单质硅
D.氟利昂和氮氧化物(NOX)都能破坏臭氧层,从而导致“温室效应”
4.随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是( )。
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60属于原子晶体 D.H2与H3属于同素异形体
5.可以用下图所示装置制备、干燥、收集的气体是( )。
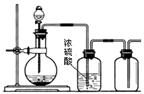 A.用MnO2和浓盐酸制备Cl2
A.用MnO2和浓盐酸制备Cl2
B.用铜和稀硝酸制备NO
C.用30% H2O2水溶液和MnO2制备O2
D.用锌和稀硫酸制备H2
6.下列判断正确的是( )。
A.冰熔化时,分子中H-O键发生断裂
B.白磷与红磷在一定条件下可互相转化,发生的变化属于物理变化
C.酸性氧化物在固态时,一定是分子晶体
D.三氧化硫晶体熔化时,一定没有破坏化学键
7.在两个密闭容器中,分别充有相同质量的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )。
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的体积比乙的体积大
D.甲的相对分子质量比乙的相对分子质量小
8.下列物质的水溶液在空气中放置一段时间后,溶液的pH下降的是(不考虑溶剂挥发)( )。
①氢硫酸;②硫酸钠;③澄清石灰水;④氯水;⑤亚硫酸钠;⑥漂白粉溶液
A.③④⑤⑥ B.①③④⑤ C.②③④⑤ D.①②⑤⑥
9. H++OH-;DH>0,下列叙述正确的是( )。
H++OH-;DH>0,下列叙述正确的是( )。
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
10.已知阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )。
A.标准状况下,
B.
C.常温常压下,
D.
11.有浓度均为0.1mol/L的①醋酸溶液;②氯化铵溶液;③硫酸溶液各25mL。下列说法正确的是( )。
A.三种溶液pH大小的顺序是①>②>③
B.若将三种溶液稀释相同倍数,pH变化最大的是①
C.三种溶液中由水电离产生的氢离子浓度大小顺序是②>①>③
D.若分别加入25mL 0.1mol/L的氢氧化钠溶液后,pH最大的是①
12.短周期元素W、X、Y、Z,W元素的一种原子无中子,X与Z同主族、与Y同周期,Y是地壳中含量最多的非金属元素,Z元素原子的最外层电子数是内层电子数的0.4倍,下列有关叙述正确的是( )。
A.XY2与ZY2的化学键类型和晶体类型相同
B.ZY2为酸性氧化物,可以与强碱反应,但不能与任何酸反应
C.XW4与XY2均为只含极性键的非极性分子
D.常温下Z的单质很稳定,既不与酸反应,也不与强碱反应
13.如图所示,下列叙述正确的是( )。
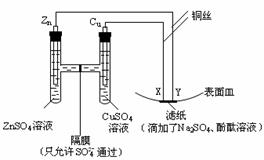
A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成 D.X与滤纸接触处变红
14.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为 xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1。下列判断错误的是(
)。
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1。下列判断错误的是(
)。
A.x=1
B.2min内A的反应速率为0.3 mol?(L?min)-1tesoon
C.B的转化率为40%
D.若混合气体的密度不变,则表明该反应已达到平衡状态
15.将充有n mLNO和m mLNO2气体的试管倒立于盛水的水槽中,然后通入n mLO2。气体体积均在同温同压下测定,且m>n,则充分反应后,试管中气体在同温同压下的体积为( )。
A.(m-n)/3 mL B.(n-m)/3 mL C.(
16.铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现有2 mol/L稀硫酸30mL,往其中加入
A.0.045 mol B.0.03 mol C.0.0225 mol D.0.02mol
二、非选择题(共60分)
17.(6分)如图所示,某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)  2SO3(g),根据下列要求填空:
2SO3(g),根据下列要求填空:
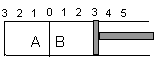 |
⑴温度不变下,固定活塞位置在3处不动,达到平衡后,设A容器压强为PA,B容器压强为PB,则PA与PB的压强是PA PB (填“<”、“>”、“=”,下同),A中SO2的浓度 B中SO2的浓度。
⑵若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x y (填“<”、“>”、“=”)。
18.(8分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3 ,请根据要求回答下列问题:
⑴已知NF3分子中所有原子均满足8电子稳定结构,则NF3分子的空间构型为
;
⑵写出该反应的化学方程式 ;
反应过程中,被氧化与被还原的元素的物质的量之比为 ;
⑶若反应中生成0.2 mol HNO3,转移的电子数目为 个。
19.(12分)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④碳酸钠,请回答下列问题:
⑴四种溶液中由水电离出的OH―浓度由大到小的顺序是(填序号)
。
⑵四种溶液中pH由小到大的顺序是(填序号) 。
⑶将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是
。
⑷已知t℃,KW=1×10-13,在t℃时pH=11的NaOH溶液50mL与 mL与该温度下pH=1的盐酸溶液反应后,溶液恰好呈中性。
20.(12分)X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素。X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂。Z、W原子最外层电子数之和是X原子最外层电子数的2倍,这四种元素的原子电子层数之和为10。请填空:
(1)X与Y组成一种有特殊臭味的气体,已知该气体与氧气按物质的量之比为1:2混合后恰好完全燃烧,生成稳定的氧化物,在同温同压下测得燃烧前后气体的总体积不变,该反应的化学方程式为 。
(2)若W的单质是有毒气体,则它与强碱溶液反应的离子方程式为
;
由Z和Y可构成具有漂白作用的化合物,其电子式为 。
(3)若W的单质为黄色固体,且W与X可形成化合物XW2。
①XW2为 结构式为 ;
②Z的单质在XY2气体中燃烧的现象为 。
(4)若W的一种单质分子为正四面体结构,可用于制造燃烧弹和烟幕弹等。实验室里少量该单质应保存在 中。
21.(14分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
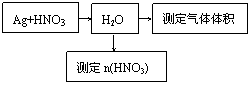


 (1)测定硝酸的物质的量
(1)测定硝酸的物质的量
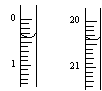
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 mol,则Ag与浓硝酸反应过程中生成的NO2体积为 mL。
(2)测定NO的体积
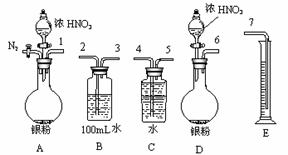
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是 (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是
。
22.(8分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取
⑴写出SO2与酸性高锰酸钾溶液反应的离子方程式
。
⑵样品中FeS2的质量分数是(假设杂质不参加反应) 。
⑶煅烧
能制得98%硫酸_________kg。
长郡中学2009届高三第四次月考化学试卷答案
题号
1
2
3
4
5
6
7
8
答案
B
C
B
D
D
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
C
C
C
A
D
A
B
17.(6分) (1) <(2分) = (2分);(2)< (2分)
18.(8分)
(1)三角锥形(2分)
(2)3 NF3 + 5 H2O =2 NO + HNO3 + 9 HF(2分) 1:2(2分)
(3)0.4NA或2.408×1023 (2分)
19.(12分)
(1)④②③①(3分)
(2)②④③①(3分)
(3)c(Na+)>c(CH3COO-) >c(OH-)>c(H+)(3分)
(4)5(3分)
|
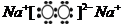
 (2分)
(2分)