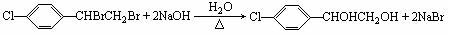江阴长泾中学2008-2009学年度第一学期12月考试高三化学试卷
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分,考试时间100分钟.
可能用到的相对原子质量:H-
S-32 Ca-40 Cu-64 Ag-108 Ba-137
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括8小题,每题3分,共24分.每小题只有一个选项符合题意)
1.化学与生产、生活、社会密切相关。下列有关说法中不正确的是 ( )
A.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识。
 B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
B.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。
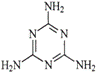
C.三鹿毒奶粉中的三聚氰胺是一种“伪蛋白”,其分子结构如右图所示,
其化学式为C3H6N6。
D.2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学
家钱永健等人。蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应。
 2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是(
)
2.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是(
)
 A.F原子结构示意图:
B.CH4分子的球棍模型
A.F原子结构示意图:
B.CH4分子的球棍模型
 C.H、D、T表示同一种核素 D.次氯酸电子式 :
C.H、D、T表示同一种核素 D.次氯酸电子式 :
3.奥运会火炬可用丙烷或丁烷作燃料.已知丙烷的沸点为-
A.奥运火炬中燃料燃烧主要是将化学能转变为热能和光能
B.烷烃的沸点和燃烧热都随碳原子数增加而成比例递增
C.异丁烷的沸点肯定低于-
D.正己烷在常温常压下肯定不是气体
4.下列现象或反应的原理解释正确的是( )
现象或反应
原理解释
A
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔对熔化的铝有较强的吸附作用
B
合成氨反应需在高温条件下进行
该反应为吸热反应
C
镀层破损后,镀锡铁比镀锌铁易腐蚀
锡比锌活泼
D
2CO=C+O2在任何条件下均不能自发进行
该反应△H>0,△S<0
5.设NA表示阿伏加德罗常数,下列说法不正确的是( )
A.1molCnH2n+2中含有(2n+1)NA个共价键
B.1mol石墨中含有NA/2个六碳环
C.常温常压下
D.将1molNO2气体进行加压,加压后气体的分子数将少于NA个
|
 ①B与C均存在同素异形体
①B与C均存在同素异形体 gM和
gM和 A.t
A.t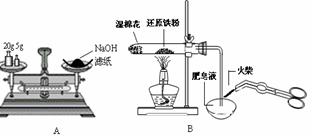
 Al(OH)3↓+3H+
Al(OH)3↓+3H+ 2X(s)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
2X(s)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )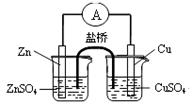 B.构成右图所示装置时,盐桥中的K+ 向左池移动
B.构成右图所示装置时,盐桥中的K+ 向左池移动
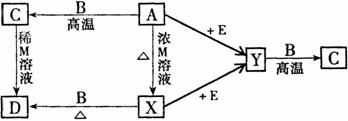 17.(10分)现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物,在一定条件下可发生下列转化:
17.(10分)现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物,在一定条件下可发生下列转化:
 a Z(g) + W(g) △H= -Q kJ?mol-1 (Q>0)
a Z(g) + W(g) △H= -Q kJ?mol-1 (Q>0)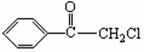
 R―
R― ―COOH
―COOH
 铜及其合金是人类最早使用的金属材料。
铜及其合金是人类最早使用的金属材料。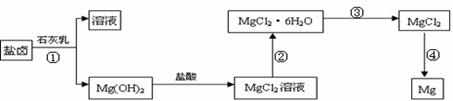
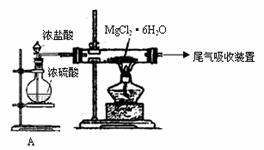
 Mn2++Cl2↑+2H2O (2分)
Mn2++Cl2↑+2H2O (2分)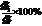 (4)
(2分)
(4)
(2分)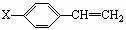 (3)① (2分)
(3)① (2分)