2008年秋季湖北省部分重点中学期中联考
高三年级化学试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页,试卷满分110分。考试时间90分钟。
1.答题前,考生务必将自己的学校、姓名、班级学号、班级填写在试卷指定位置。
2.第Ⅰ卷答案写在第Ⅱ卷卷首答题栏内,第Ⅱ卷答案写在各题指定答题处。
本卷可能用到的相对原子质量:
H:1 O:16 C:12 N:14 S:32 Cl:35.5 Na:23 Mg:24 Fe:56
K:39 Si:28 Ca:40 Cu:64 Ba:137
第Ⅰ卷(选择题,共48分)
一、选择题(本大题共1 6个小题,每小题3分,共48分。每小题只有一个选项符合题意,请将所选答案填在第Ⅱ卷指定的答题栏内)
1.下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO 2的量
B.臭氧的体积分数超过10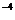 %的空气有利于人体健康
%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
2.下列各溶液中,Na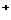 浓度最大的是
浓度最大的是
A.0.8 L 0.4 mol/L的NaOH溶液
B.0.2 L 0.15 mol/L的Na 3 PO 4溶液
C.1 L 0.3 mol/L的NaCl溶液
D.4 L0.5 mol/L的NaCl溶液
 3.2008年9月中国爆发了三鹿奶粉事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症。经调查是一些不法商人用三聚氰胺作奶粉添加剂,以提升奶粉检测中的蛋白质含量指标和增加产品的含水量。以下有关三聚氰胺(结构简式如图)的说法错误的是
3.2008年9月中国爆发了三鹿奶粉事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症。经调查是一些不法商人用三聚氰胺作奶粉添加剂,以提升奶粉检测中的蛋白质含量指标和增加产品的含水量。以下有关三聚氰胺(结构简式如图)的说法错误的是
A.该分子为非极性分子
B.该物质的水溶液显弱碱性,能与盐酸反应
C.该物质有毒,不能作食品添加剂
D.三聚氰胺为有刺激性气味的深黄色物质
 4.下列选项中不能用如图表示物质或概念间从属关系的是
4.下列选项中不能用如图表示物质或概念间从属关系的是
X
Y
Z
例
氧化物
化合物
纯净物
A
苯的同系物
芳香烃
芳香族化合物
B
电解质
离子化合物
化合物
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
5.根据热化学方程式:S(s)+O 2(g)====SO 2(g);△H=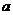 kJ?mol
kJ?mol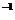 (
(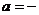 297.2)分析,下列说法不正确的是
297.2)分析,下列说法不正确的是
A.S (s)在O2(g)中燃烧的反应是放热反应
B.S(g)+O 2(g)====SO 2(g);△H=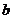 kJ?mol
kJ?mol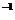 ,则
,则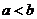
C.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量
D.1 mol SO 2(g)所具有的能量低于1 mol S(s)与1 mol O 2(g)所具有的能量之和
6.下列说法正确的是
A.碱金属离子的氧化性比较为:Li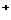 <Na
<Na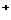 <K
<K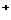 <Rb
<Rb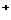
B.SO 2和O3同时通入装有湿润的有色布条的集气瓶中,漂白效果更好
C.某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水
D.沸点高低比较为:H2O>HF>NH3
7.对于3BrF3+5H2O====HBrO3+Br2+9HF+O2反应,若有5 mol水充当还原剂,则被水还原的BrF3的物质的量为
A.2/3mol B.10/3mol C.2mol D.4/3mol
8.设NA为阿伏加德罗常数,下列说法正确的是
A.58.5 g氯化钠中约含有6.02×1023个氯化钠分子
B.标准状况下,1.12 L的H2O所含的原子数必大于1.5×6.02×1023
C.9 g重水所含有的电子数为5NA
D.12.5 mL 16 mol?L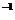 浓硫酸与足量铜反应,转移电子数为0.2NA
浓硫酸与足量铜反应,转移电子数为0.2NA
9.下列离子方程式书写正确的是
A.氯气与水反应:Cl2+H2O====2H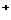 +Cl
+Cl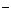 +ClO
+ClO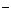
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO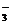 +5I
+5I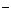 +3H2O====3I2+6OH
+3H2O====3I2+6OH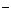
C.Na投入水中:Na+2 H2O ====Na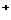 +2 OH
+2 OH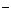 +H2↑
+H2↑
D.Ca(OH)2溶液与足量Ca(HCO3)2溶液混合:Ca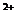 +OH
+OH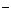 +HCO
+HCO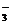 ====CaCO3↓+ H2O
====CaCO3↓+ H2O
10.短周期元素X、Y、Z和W的原子序数依次递增,且均为同周期,四元素原子的最外层电子数之和为18,X和Y的原子序数比为6:7,X的最高正价是W的最低负价绝对值的2倍。下列说法不正确的是
A.Y的单质可能为原子晶体
B.X和W可组成离子化合物
C.Z和W的单质发生化学反应可生成两种共价化合物
D.Z和W的最高价氧化物对应的水化物都是强酸
11.下图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是

12.下列条件下,两瓶气体所含原子数不相等的是
A.同质量、不同密度的N 2和CO B.同温度、同压强、同体积的T2和N2
C.同体积、同密度的C2 H4和C3 H6 D.同质量、同体积的N 2 O和13CO2
13.中学化学中涉及到一些重要的化学工业,以下有关化工生产叙述正确的是
A.氯气通入到饱和的石灰水中可制得大量漂粉精
B.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来
C.工业上,用SiO2+2C Si+2CO↑制得粗硅
Si+2CO↑制得粗硅
D.接触法制H2SO4在接触室中SO2氧化条件一般选择高温、高压、催化剂
14.关于某无色透明溶液中所含离子的鉴别,下列叙述正确的是
A.加入Ba(NO3)2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定有SO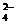
B.加入AgNO3溶液,生成白色沉淀且不溶于稀盐酸,则原溶液中一定有Cl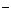
C.加入盐酸,生成的气体能使饱和的澄清石灰水变浑浊,则原溶液中一定有CO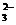
D.加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定有NH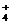
15.下列溶液中,能大量共存的离子组是
A.能使氢氧化铝迅速溶解的溶液:Na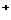 、Fe
、Fe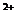 、NO
、NO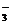 、SO
、SO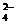
B.c(H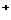 )=1×10
)=1×10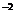 mol?L
mol?L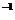 的溶液:Ba
的溶液:Ba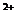 、Na
、Na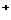 、NH
、NH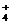 、SO
、SO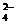
C.含有大量SO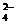 的溶液:K
的溶液:K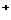 、Cu
、Cu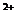 、Cl
、Cl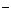 、NO
、NO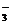
D.含有大量ClO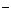 的溶液:H
的溶液:H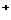 、Mg
、Mg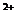 、I
、I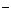 、SO
、SO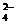
16.下列实验中,由于错误操作导致所测出的数据一定偏低的是
A.用量筒量取一定体积的液体时,俯视读出的读数
B.用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值
C.测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量
D.做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值
第Ⅱ卷(非选择题,共62分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。
2.答卷前,将密封线内的项目填写清楚。
二、(本大题包括2小题,共24分)
17.(13分)
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第VIA族和几种元素的位置。请回答下列问题:

(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请用电子式表示LiH的形成过程:
(3)f与c或g均能形成一些化合物,据有关资料f与c能形成化合物fc6,f能与g能形成化合物f2g2。请回答下面问题:
①甲同学通过分析认为fc6此物质不可在O2中燃烧,原因是: ,通过测定知此物质中的6个c原子在分子结构中等效,则fc6分子空间构型为:
②乙同学通过查资料知化合物f2g2中既存在极性键,又存在非极性键,试写出其电子式: ;该物质遇水不稳定,生成一种黄色沉淀和无色气体,还得到一种酸性溶液。试写出该过程的反应方程式:
(4)下列叙述正确的是
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c与h形成化合物的水溶液显中性
D.离子半径:f>g>h>d
E.f与d形成离子化合物为电解质,故该晶体能导电
F.a、d、e常见氧化物熔沸点高低比较:e>d>a
18.(11分)
A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期。它们中的两种元素可形成多种原子个数比为1:1的化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表:
化合物
甲
乙
丙
丁
元素种类
A、B
A、C
A、D
C、D
通常情况下,甲为气体,密度比空气小;乙为液体;丙和丁为固体且均为离子化合物。请填写下列空白:
(1)乙的电子式为 ,丁中阴离子与阳离子的个数比为
(2)已知甲是同系列中最简单的化合物,且在标准状况下,5.6 L的甲完全燃烧放出的热量为325 kJ,试写出甲的燃烧热的热化学方程式
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式
(4)已知丙的晶体结构与NaC!相似,则该晶体中与D离子距离最近的D离子有 个;有资料显示,丙是一种危险物质,其反应活性很高,在潮湿的空气中能自燃。试写出相应的化学方程式
(5)A、B、C、D所对应元素的原子半径大小顺序为 (用元素符号表示)。
三、(本题包括3小题,共29分)
19.(8分)
A、B、C、D、E五小烧杯透明溶液,分别是HCl、BaCl2、NaHSO4、K2CO3、AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式是 。
(2)A是 ,C是 ,D是
(3)A与E反应的离子方程式是
(4)某同学计划检验A中的阳离子,他还需要哪些仪器和药品:
 20.(9分)
20.(9分)
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转化关系如图所示(部分产物略去)。
(1)若A和E为单质且B物质为由极性键形成的非极性分子。B的电子式为: ,M的原子序数比A大76,则M位于元素周期表中第 周期 族。试写出M的最高价氧化物与浓盐酸反应得到单质气体C的化学反应方程式:
(2)若A、B、D、E均为高熔点的物质且E、D为单质,写出A→B的化学方程式: 。D的原子结构示意图: .
(3)若A为可溶性强碱(MOH),E为同主族元素形成的常见非金属化合物,且该化合物中两元素的质量比为l:1,试写出A→B的化学方程式:
21.(12分)
某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2气体,写出A中发生反应的化学方程式: 。某同学在实验时发现打开A中的分液漏斗活塞后,漏斗中液体没流下,你想原因可能是:
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式: ,指出该反应中的液体反应物在反应中所表现出的性质: 。
(3)①反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: :(填写序号字母)
I.都褪色 II.都不褪色 Ⅲ.B褪色,D不褪色 Ⅳ.B不褪色,D褪色
②停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B: ,D: 。
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快。为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下实验装置:

①实验开始后,乙装置中出现的现象:
②用离子方程式表示乙中产生该现象的原因:
四、(本题包括1小题,9分)
22.(9分)
2 g Cu2 S和CuS的混合物在酸性溶液中用400 mL 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO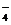 +5Cu2 S+44H
+5Cu2 S+44H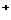 ====10Cu
====10Cu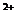 +5SO2+8Mn
+5SO2+8Mn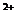 +22H2O
+22H2O
6MnO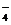 +5CuS+28H
+5CuS+28H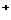 ====5Cu
====5Cu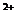 +5SO2+6Mn
+5SO2+6Mn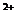 +14H2O
+14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol/L(NH4)2 Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2 Fe(SO4)2反应的离子方程式:
MnO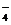 + Fe
+ Fe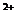 + H
+ H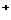 ====
Mn
====
Mn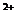 + Fe
+ Fe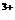 + H2O
+ H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500 mL 0.1 mol/L Fe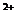 溶液,需称取(NH4)2 Fe(SO4)2?6 H2O(M=392 g/mol)的质量为
溶液,需称取(NH4)2 Fe(SO4)2?6 H2O(M=392 g/mol)的质量为
(4)混合物中Cu2S的质量分数为
2008年秋季湖北省部分重点高中期中联考
题号
1
2
3
4
5
6
7
8
答案
A
D
D
B
B
D
B
B
题号
9
10
11
12
13
14
15
16
答案
D
D
B
D
C
D
C
D
17.(1)Fe及Fe后两纵行涂黑(1分)

 (2)∶Li?+?H → Li+[H∶] (2分)
(2)∶Li?+?H → Li+[H∶] (2分)
(3)①硫在SF 中显+6价不可再升,O
中显+6价不可再升,O 不可将负一价氟氧化。(2分)
不可将负一价氟氧化。(2分)
正八面体(1分)
|
 O
O kJ/mol(2分)
kJ/mol(2分)
 (3)H
(3)H +H
+H HO
HO (只写第一步算对)(2分)
(只写第一步算对)(2分) C:AgNO
C:AgNO +2H
+2H


 (2)SiO
(2)SiO
 21.(1)H
21.(1)H +Na
+Na
 Mn
Mn +Cl
+Cl +2Cl
+2Cl